题目内容
【题目】(1)工业上可利用CO2和H2生成甲醇,热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=Q1kJ·mol-1
CH3OH(g)+H2O(g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2O2(g)![]() CO2(g)+H2(g) △H=Q2kJ·mol-1
CO2(g)+H2(g) △H=Q2kJ·mol-1
②H2O(g)= H2O(I) △H=Q3kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为________________。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
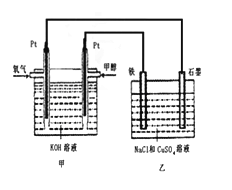
(2)写出甲中通入甲醇这一极的电极反应式_______________________。
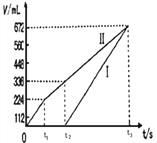
(3)理论上乙中两极所得气体的体积随时间变化的关系如图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式___________,原混合溶液中NaCl的物质的量浓度为_______mol/L。(设溶液体积不变)
(4)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_________g。
(5)已知草酸H2C2O4为弱酸。
①常温下,下列事实能说明草酸是弱电解质的是____________。
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,PH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同PH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4-)+2c(C2O42-)=________________。(用准确的数学表达式表示)
【答案】 CH3OH(l)+3/2O2(g) ═CO2(g)+2H2O(l) ΔH=(2Q1 +3Q2+2Q3) kJ·mol-1 CH3OH-6e+8OH═CO32+6H2O 4OH4e═O2↑+2H2O 0.1 1.28 ABD 0.05+ 10-610-8
【解析】试题分析:(1)根据盖斯定律计算焓变;(2)通入甲醇的一极为负极,甲醇失电子被氧化生成碳酸钾和水;(3)阴极依次发生的电极反应为![]() 、
、![]() ,阳极依次发生
,阳极依次发生![]() 、
、![]() ;
;
(4)根据得失电子守恒计算析出铜的质量;(5)根据弱酸部分电离,溶液中存在电离平衡分析。
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液浓度相同,等体积混合恰好生成草酸氢钠。
解析:(1)
①CH3OH(l)+1/2O2(g) ![]() CO2(g)+H2(g) △H=Q2kJ·mol-1
CO2(g)+H2(g) △H=Q2kJ·mol-1
②H2O(g)= H2O(I) △H=Q3kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=Q1kJ·mol-1,根据盖斯定律3×①+2×③+2×②得CH3OH(l)+3/2O2(g) ═CO2(g)+2H2O(l) ΔH=(2Q1 +3Q2+2Q3) kJ·mol-1;(2)通入甲醇的一极为负极,甲醇失电子被氧化生成碳酸钾和水,负极反应为CH3OH-6e+8OH═CO32+6H2O ;(3)阴极依次发生的电极反应为
CH3OH(g)+H2O(g) △H=Q1kJ·mol-1,根据盖斯定律3×①+2×③+2×②得CH3OH(l)+3/2O2(g) ═CO2(g)+2H2O(l) ΔH=(2Q1 +3Q2+2Q3) kJ·mol-1;(2)通入甲醇的一极为负极,甲醇失电子被氧化生成碳酸钾和水,负极反应为CH3OH-6e+8OH═CO32+6H2O ;(3)阴极依次发生的电极反应为![]() 、
、![]() ,阳极依次发生
,阳极依次发生![]() 、
、![]() ;石墨是阳极,Ⅱ是阳极反应曲线;铁是阴极,Ⅰ是阴极反应曲线;根据图像,在t1后,石墨电极上是氢氧根离子放电,电极反应式4OH4e═O2↑+2H2O;根据图像,生成氯气的体积为224mL(0.01mol),原混合溶液中NaCl的物质的量浓度为0.01mol×2÷0.2L=0.1 mol/L;(4)当向甲装置中通入标况下的氧气336mL时,转移电子的物质的量为
;石墨是阳极,Ⅱ是阳极反应曲线;铁是阴极,Ⅰ是阴极反应曲线;根据图像,在t1后,石墨电极上是氢氧根离子放电,电极反应式4OH4e═O2↑+2H2O;根据图像,生成氯气的体积为224mL(0.01mol),原混合溶液中NaCl的物质的量浓度为0.01mol×2÷0.2L=0.1 mol/L;(4)当向甲装置中通入标况下的氧气336mL时,转移电子的物质的量为![]() ,根据图示,阴极发生
,根据图示,阴极发生![]() 反应时,阳极生共成0.1mol氯气、0.05mol氧气,共转移电子0.04mol,所以共生成0.02mol铜,质量为1.28g。(5) ①A.向草酸钠溶液加酚酞,溶液变红,说明醋酸根水解,故A正确;
反应时,阳极生共成0.1mol氯气、0.05mol氧气,共转移电子0.04mol,所以共生成0.02mol铜,质量为1.28g。(5) ①A.向草酸钠溶液加酚酞,溶液变红,说明醋酸根水解,故A正确;
B.取一定量草酸溶液加水稀释至10倍,PH变化小于1,说明草酸电离平衡正向移动,故B正确;
C.草酸能使酸性KMnO4溶液褪色,说明草酸具有还原性,故C错误;
D.取相同PH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快,说明草酸溶液中电离平衡正向移动,故D正确;
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液浓度相同,等体积混合恰好生成草酸氢钠,溶液的pH为6,根据物料守c(Na+)=0.05mol/L,恒根据电荷守恒,则
c(HC2O4-)+2c(C2O42)+ c(OH-)= c(Na+)+ c(H+),c(HC2O4-)+2c(C2O42) = c(Na+)+ c(H+)- c(OH-)=0.05+ 10-610-8;

 备战中考寒假系列答案
备战中考寒假系列答案