题目内容
【题目】高温下炼铁的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g) - Q
(1)写出该反应的平衡常数的表达式_____________________。当混合气体的________________(填物理量名称)不变时,表明上述反应已达到平衡。
(2)写出一种能提高上述反应中氧化铁转化率的措施__________________。取一定量铝热剂,在高温下进行铝热反应:2Al + Fe2O3 ![]() 2Fe + Al2O3。
2Fe + Al2O3。
(3)请标出电子转移的方向和数目。若反应中有 1.5 mol 电子转移,可得到铁_______g。
(4)将铝热剂直接加到足量氢氧化钠溶液中,有气体生成。请写出该现象对应的离子方程式。
_____________________________________________
(5)若将铝热反应后所得固体用足量盐酸溶解,并加入硫氰化钾溶液,溶液不变血红色。据此能否确认固体中已不含氧化铁?说明理由。
______________________________________________________________________
______________________________________________________________________
【答案】 K=[c(CO2)]3/[c(CO)]3 质量、平均分子量、密度等(合理即给分) 升高温度、提高一氧化碳的浓度、及时移走二氧化碳等(合理即给分) 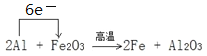 28 2Al + 2H2O + 2OH— → 2AlO2— + 3H2↑ 不能确认、因为所得固体中有铁,会将 Fe3+还原为 Fe2+
28 2Al + 2H2O + 2OH— → 2AlO2— + 3H2↑ 不能确认、因为所得固体中有铁,会将 Fe3+还原为 Fe2+
【解析】 (1)该反应的平衡常数的表达式为K=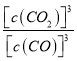 。根据方程式,当混合气体的质量、平均分子量、密度等不变时,表明上述反应已达到平衡,故答案为:K=
。根据方程式,当混合气体的质量、平均分子量、密度等不变时,表明上述反应已达到平衡,故答案为:K=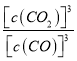 ;质量、平均分子量、密度等;
;质量、平均分子量、密度等;
(2)要提高上述反应中氧化铁转化率,需要平衡正向移动,可以采取的措施有升高温度、提高一氧化碳的浓度、及时移走二氧化碳等,故答案为:升高温度、提高一氧化碳的浓度、及时移走二氧化碳等;
(3)该铝热反应中电子转移的方向和数目表示为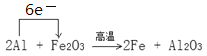 。根据方程式,反应中有 1.5 mol 电子转移,得到铁0.5mol,质量为0.5mol×56g/mol=28g,故答案为:
。根据方程式,反应中有 1.5 mol 电子转移,得到铁0.5mol,质量为0.5mol×56g/mol=28g,故答案为: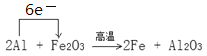 ;28;
;28;
(4)将铝热剂直接加到足量氢氧化钠溶液中,有气体生成,是未反应的铝与氢氧化钠反应放出了氢气,反应的离子方程式为2Al + 2H2O + 2OH— =2AlO2— + 3H2↑,故答案为:2Al + 2H2O + 2OH— =2AlO2— + 3H2↑;
(5)将铝热反应后所得固体用足量盐酸溶解,并加入硫氰化钾溶液,溶液不变血红色。据此不能确认固体中已不含氧化铁,因为所得固体中有铁,会将 Fe3+还原为 Fe2+,故答案为:不能确认;因为所得固体中有铁,会将 Fe3+还原为 Fe2+。

【题目】某一烃分子中有一个由C-C键构成的六元环,有一个C=C键,还有一个C≡C键,则能满足上述条件的烃的分子式可能是( )
A. C8H10 B. C14H22 C. C12H22 D. C10H16
【题目】(1)已知NO2和N2O4的结构式如右图所示。已知:N—N的键能为a kJ/mol,NO2和N2O4中N=O键键能分别是b kJ/mol和c kJ/mol。写出NO2转化为N2O4的热化学方程式________________(△H用a、b、c的代数式表示)。

(2)在100℃时,将0.4mol NO2放入2L的真空容器中发生反应:2NO2![]() N2O4。测得容器内气体的物质的量随时间变化如下表:
N2O4。测得容器内气体的物质的量随时间变化如下表:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①上述条件下,前20s内以NO2表示的平均化学反应速率为_________________________;达到平衡状态时,NO2的转化率是________。
②n2_______ n3(填“>”、“=”、“<”)。
③80s时,向容器内加入NO2和N2O4各0.24mol,化学平衡将_________(填“向正反应方向移动”、“ 向逆反应方向移动”、“不移动”)。
④若将NO2的起始物质的量改为0.2mol,在相同条件下进行实验,要想达到与上述平衡相同的平衡状态,则起始时还需要加入适量的N2O4气体,则N2O4的浓度为_____________。