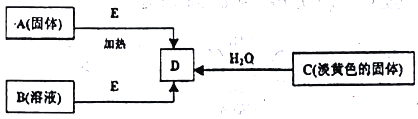
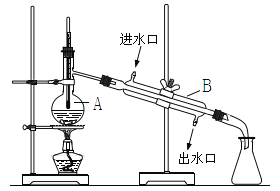
题目内容
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图l所示:
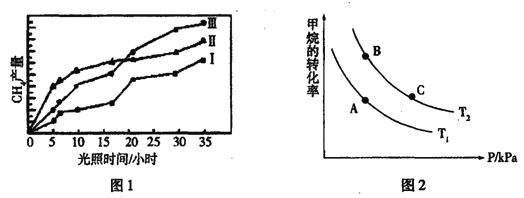
①在0~30小时内,CH4的平均生成速率vI、vⅡ和vⅢ从小到大的顺序为________;反应开始后的12小时内,在第____种催化剂的作用下,收集的CH4最多。
②将所得的CH4与H2O(g)通入聚焦太阳能反应器,发生CH4(g)+H2O(g)![]() CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
③维持温度T2,将0.04mol CH4(g)和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=________。
④下列现象能说明该反应已经达到平衡状态的是________(填编号)。
A.容器内CH4、H2O、CO、H2单位物质的量之比为1:1:1:3
B.容器内气体的密度恒定
C.容器内气体的压强恒定
D.3v( CO)=v(H2)
(2)LiBH4为近年来常用的储氢材料。
①反应2LiBH4 =2LiH+2B +3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____ mol。
②图3是2LiBH4/MgH2体系放氢焓变示意图,则:Mg(s) +2B(s) =MgB2(s) △H=____。
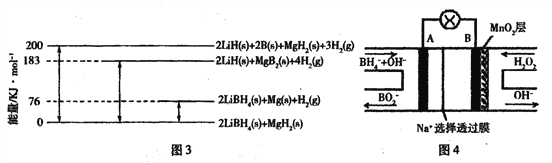
(3)图4是直接硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH___(填“增大”、“减小”或“不变”),负极的电极反应式为____。
【答案】 v I ⅡⅢ Ⅱ > < 0.0108 C 2 -93 kJ/mol 增大 BH4--8e-+8OH-=BO2-+6H2O
【解析】试题分析:本题考查图像的分析,外界条件对化学平衡的影响,化学平衡常数的计算,化学平衡的标志,氧化还原反应中转移电子的计算,反应热的计算,原电池原理和电极反应式的书写。
(1)①根据图1,0~30小时内,CH4的产量是III![]() II
II![]() I,0~30小时内CH4的平均生成速率υI
I,0~30小时内CH4的平均生成速率υI![]() υII
υII![]() υIII。反应开始后的12小时内,CH4的产量II
υIII。反应开始后的12小时内,CH4的产量II![]() III
III![]() I,反应开始后的12小时内在第II种催化剂的作用下收集的CH4最多。
I,反应开始后的12小时内在第II种催化剂的作用下收集的CH4最多。
②在横坐标上取一点,作横坐标的垂直线,可见T2时CH4的转化率大于T1时,T2![]() T1,升高温度CH4的转化率增大,升高温度平衡向正反应方向移动,正反应为吸热反应,ΔH
T1,升高温度CH4的转化率增大,升高温度平衡向正反应方向移动,正反应为吸热反应,ΔH![]() 0。C点温度高于A点,升高温度平衡向正反应方向移动,则KA
0。C点温度高于A点,升高温度平衡向正反应方向移动,则KA![]() KC。
KC。
③用三段式, CH4(g) + H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
n(起始)(mol) 0.04 0.04 0 0
n(转化)(mol)0.04![]() 50%=0.02 0.02 0.02 0.06
50%=0.02 0.02 0.02 0.06
n(平衡)(mol) 0.02 0.02 0.02 0.06
平衡时CH4、H2O、CO、H2物质的量浓度依次为0.02mol/L、0.02mol/L、0.02mol/L、0.06mol/L,此温度下反应的平衡常数KB=![]() =
=![]() =0.0108。
=0.0108。
④A,达到平衡时各物质的浓度不变,不一定等于化学计量数之比,容器内CH4、H2O、CO、H2物质的量之比为1:1:1:3不一定达到平衡状态;B,该反应中所有物质都呈气态,根据质量守恒定律,气体的总质量始终不变,容器的容积不变,容器内气体的密度始终不变,容器内气体的密度恒定不能说明反应达到平衡状态;C,该反应的正反应是气体分子数增大的反应,建立平衡过程中气体分子物质的量增大,恒容容器中气体压强增大,平衡时气体分子物质的量不变,容器内气体压强不变,容器内气体的压强恒定能说明反应达到平衡状态;D,3υ(CO)=υ(H2)没有指明是正反应速率还是逆反应速率,不能说明反应达到平衡状态;能说明反应达到平衡状态的是C项,答案选C。
(2)①用单线桥分析反应为![]() ,生成3molH2转移6mo电子,n(H2)=
,生成3molH2转移6mo电子,n(H2)=![]() =1mol,转移电子物质的量为2mol。
=1mol,转移电子物质的量为2mol。
②根据图示可写出下列热化学方程式,
2LiH(s)+2B(s)+3H2(g)=2LiBH4(s)ΔH=-200kJ/mol(①式)
2LiH(s)+MgB2(s)+4H2(g)=2LiBH4(s)+MgH2(s)ΔH=-183kJ/mol(②式)
Mg(s)+H2(g)=MgH2(s)ΔH=-76kJ/mol(③式)
应用盖斯定律,①式-②式+③式得,Mg(s)+2B(s)=MgB2(s)ΔH=(-200kJ/mol)-(-183kJ/mol)+(-76kJ/mol)=-93kJ/mol。
③根据图示B电极的电极反应式为H2O2+2e-=2OH-,B电极上发生得电子的还原反应,B电极为正极,正极生成OH-,电池工作时正极附近碱性增强,溶液的pH增大。A电极为负极,由图示负极电极反应为BH4--e-+OH-→BO2-+H2O,H元素的化合价由BH4-中的-1价升至H2O中+1价,1molBH4-反应失去8mol电子,则负极反应式为BH4--8e-+8OH-=BO2-+6H2O。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1. 77×10 -4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,HCOOH( aq) +OH -( aq)=HCOO-(aq) +H2O(1) △H=-a kJ/mol
H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol
甲酸电离的热化学方程式为______________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____。
⑤室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_____________,溶液中![]() ___________。
___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
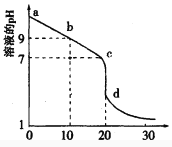
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=_____(用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(3)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。