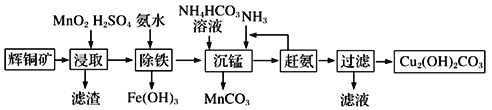
题目内容
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 1 mol·L-1的NaHCO3 溶液中含有HCO3-的数目为NA
B. 78 g 苯含有C=C 双键的数目为3NA
C. 常温常压下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
D. 冰醋酸和葡萄糖的混合物30g含有碳原子数为NA
【答案】D
【解析】
A、HCO3-既能电离又能水解,故溶液中含有的HCO3-的数目小于NA,选项A错误;B.78g苯的物质的量为1mol,由于苯分子中的碳碳键为一种独特键,不存在碳碳双键,选项B错误;C、常温常压下,6.72L二氧化氮的物质的量小于0.3mol,而0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,选项B错误;D、乙酸和葡萄糖的最简式均为CH2O,30g由乙酸和葡萄糖组成的混合物中含有CH2O物质的量为![]() =1mol,含有碳原子个数为1mol×1×NA=NA,选项D正确;答案选D。
=1mol,含有碳原子个数为1mol×1×NA=NA,选项D正确;答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=-58 kJmol-1,则ΔH3=______。
已知:CO中的化学键是C≡O,CH3OH的结构式为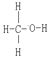 。
。
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=______kJ·mol-1。
(3)中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
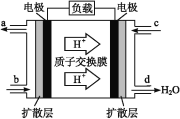
①该电池工作时,b口通入的物质为___。
②该电池正极的电极反应式为______________。
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有____NA个电子转移。
【题目】已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
N2 | H2 | NH3 | |
起始浓度(mol/L) | 1.0 | 3.0 | 0.2 |
2s末浓度(mol/L) | 0.6 | 1.8 | 1.0 |
4s末浓度(mol/L) | 0.4 | 1.2 | 1.4 |
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
A. 2~4 s内的平均反应速率为0.2 mol·L-1·s-1
B. 前4 s内的平均反应速率为0.3 mol·L-1·s-1
C. 前2 s内的平均反应速率为0.4 mol·L-1·s-1
D. 2 s末的反应速率为0.4 mol·L-1·s-1