��Ŀ����
����Ŀ��25��ʱ����1L���ܱ������г���NO2�������·�Ӧ��2NO2(g)![]() N2O4(g)��H=��57 kJ��mol-1��N2O4��25��ʱΪ��ɫ���壩��
N2O4(g)��H=��57 kJ��mol-1��N2O4��25��ʱΪ��ɫ���壩��
��1���÷�Ӧ����S__________0������������������������������
��2������ʼ����0.03mol��NO2ʱ��25��ʱ��ʵ����NO2��ƽ��Ũ��Ϊ0.01 mol��L-1����NO2��ƽ��ת���ʣ�������_____________��25��ʱ������Ӧ��ƽ�ⳣ��K =_________��
��3��25��ʱ��ʵ���ø÷�Ӧ�Ļ��Ea=92.4 kJ��mol-1������������ϵͼ��������_____��
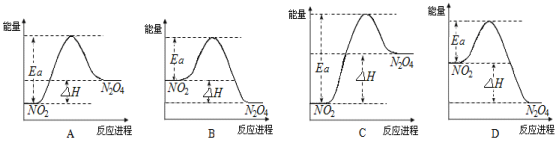
��4����Ѹ��ܱ���������80������ˮ�У����������ɫ___________����������������������������dz������NO2��ת����___________����������������������������С������
���𰸡��� 66.7% 100 B ���� ��С
��������
��1��2NO2��g��N2O4��g����H=-57kJmol-1�����ݷ�Ӧ������֪��Ӧ�����������С�������ر�С��0����S��0��
��2����1L���ܱ������г���NO2�������·�Ӧ��2NO2��g��N2O4��g����H=-57kJmol-1������ʼ����0.03mol��NO2ʱ��25��ʱ��ʵ����NO2��ƽ��Ũ��Ϊ0.01molL-1�����ݻ�ѧƽ������ʽ��ʽ���㣺����������ʼŨ��Ϊ0.03mol/L��
2NO2��g��N2O4��g��
��ʼ����mol/L�� 0.03 0
�仯����mol/L�� 0.02 0.01
ƽ������mol/L�� 0.01 0.01
NO2��ƽ��ת���ʣ�����=![]() ��100%=66.7%��
��100%=66.7%��
ƽ�ⳣ��K=![]() =
= ![]() =100L/mol��
=100L/mol��
��3�����ݷ�Ӧ�Ƿ��ȷ�Ӧ�������������������������������������ͼ����������ֵ���ڷ�Ӧ�ʱ��жϣ�B���ϣ�A��C�ж�������������������������������Dѡ������ֵС�ڷ�Ӧ�ʱ䣬���ʴ�ΪB��
��4��2NO2��g��N2O4��g����H=-57kJmol-1����Ӧ�Ƿ��ȷ�Ӧ�����������Ǻ���ɫ���壬��������������ɫ���壬����80�����ˮ�У�ƽ��������У�������ɫ���NO2��ת���ʼ�С��