题目内容
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
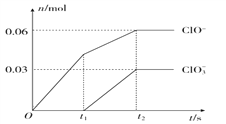
A. 反应中转移电子的物质的量是0.21mol
B. 一定有3. 36L氯气参加反应
C. 苛性钾溶液中KOH的质量是16.8g
D. ClO的生成可能是由于温度升高引起的
【答案】B
【解析】A.氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和氯酸钠,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,故转移电子物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故A正确;B.根据氯原子守恒可知参加反应的氯气为0.15mol,氯气的状态未知,不能确定其体积,故B错误;C.根据电子转移守恒可知n(Cl-)=0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则n(KOH)=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故C正确;D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;故答案为B。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目