��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ������ڱ��е�λ�ã��ش��������⣺
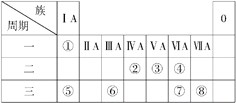
��.��1���뻭��Ԫ�آ�����ӽṹʾ��ͼ�� _______________��
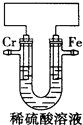
��2���ߺ͢������������Ӧˮ���������ǿ��Ϊ______>______���ѧʽ����
��3���ܢ�����Ԫ�ص�ԭ�Ӱ�1��1��ɵij���������ĵ���ʽΪ________��
��.��������A��B��C�����б��Т������е�һ�ֻ���Ԫ�أ��ɷ������·�Ӧ(����������ȥ)���Իش�
![]()
![]()
![]()
![]()
![]()
��1����X��ǿ�����Ե��ʣ���A������______ (�����)��
a��S���� b��Na ��c��Al����d��NH3����e��CH4
��2����X��һ�ֳ������ɽ������ʣ���C��ˮ��Һ�еμ�AgNO3��Һ������������ϡHNO3�İ�ɫ������д����Ӧ�ڵĻ�ѧ����ʽ�� ____________________��
��3����A��B��CΪ����ͬһ����Ԫ�صĻ����XΪǿ����ʣ�A��Һ��C��Һ��Ӧ����B��д��A��C����Һ��Ӧ�����ӷ���ʽ�� _____________________��
���𰸡� 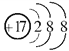 HClO4 H2SO4
HClO4 H2SO4 ![]() abde 2FeCl3+Fe=3FeCl2 Al3����3AlO
abde 2FeCl3+Fe=3FeCl2 Al3����3AlO![]() ��6H2O===4Al(OH)3��
��6H2O===4Al(OH)3��
��������������Ҫ����Ԫ�����ڱ���Ԫ�������ɡ����������ж�Ԫ�آ١���ֱ����⡢̼�����������ơ��������ȡ�
��.��1��Ԫ�آ�����ӽṹʾ��ͼ��![]() ��
��
��2��Ԫ�طǽ�����Խǿ��������������ˮ��������Խǿ���ǽ�����Cl>S�����Ԣߺ͢������������Ӧˮ���������ǿ��ΪHClO4>H2SO4��
��3���ܢ�����Ԫ�ص�ԭ�Ӱ�1��1��ɵij���������ĵ���ʽΪ![]() ��
��
��.��1��a��S+ O2![]() SO2��2SO2��O2
SO2��2SO2��O2![]() 2SO3��b��4Na+O2
2SO3��b��4Na+O2![]() 2Na2O��2Na2O+O2
2Na2O��2Na2O+O2![]() 2Na2O2��c�����������⣻d��4NH3+5O2
2Na2O2��c�����������⣻d��4NH3+5O2![]() 4NO+6H2O��2NO+O2
4NO+6H2O��2NO+O2![]() 2NO2��e��2CH4+3O2
2NO2��e��2CH4+3O2![]() 2CO +4H2O��2CO+O2
2CO +4H2O��2CO+O2![]() 2CO2����ѡabde��
2CO2����ѡabde��
��2����X��һ�ֳ������ɽ������ʣ���X��������ɫ�������Ȼ�����A��������B���Ȼ�����C���Ȼ���������Ӧ�ڵĻ�ѧ����ʽ��2FeCl3+Fe=3FeCl2��
��3��A��B��C�ֱ�Ϊƫ�����Ρ��������������Σ�XΪǿ��������A��B��C�ֱ�Ϊ���Ρ�����������ƫ�����Σ�XΪǿ����A��C����Һ��Ӧ�����ӷ���ʽ��Al3����3AlO![]() ��6H2O===4Al(OH)3����
��6H2O===4Al(OH)3����