题目内容
【题目】滴定实验在化学分析中有重要应用,现用浓度为0.1000molL-1酸性KMnO4标准溶液滴定未知浓度的草酸(H2C2O4):
(1)写出滴定过程中发生反应的离子方程式为 _____________________________________ 。
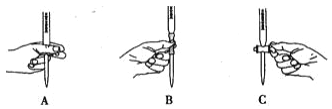
(2)滴定过程中操作滴定管的图示正确的是 _______________ 。
(3)若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果_____(选填:“偏大”、“偏小”或“不变”)。
(4)该滴定实验滴定终点的现象是_____________________________________ 。
(5)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。量取一定体积的Na2Cr2O7溶液时,需要用______(酸式或碱式)滴定管;该水样的COD为___________________________mg/L;
【答案】 2MnO4-+5H2C2O4+6H+= 2Mn2++ 10CO2↑+ 8H2O A 偏大 滴入最后一滴溶液时,锥形瓶中溶液颜色由无色变成紫红色,且半分钟内不退色 酸式 480C1V1-80C2V2
【解析】(1)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)根据滴定管的使用规则,滴定时,左手包住滴定管的活塞控制液滴的滴出,防止活塞被意外打开,即如图A所示操作;故答案为:A;
(3)若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,测定结果偏大;故答案为:偏大;
(4)该滴定实验中使用了高锰酸钾,滴定终点的现象是滴入最后一滴溶液时,锥形瓶中溶液颜色由无色变成紫红色,且半分钟内不退色,故答案为:滴入最后一滴溶液时,锥形瓶中溶液颜色由无色变成紫红色,且半分钟内不褪色;
(5)①Na2Cr2O7溶液具有强氧化性,应该用酸式滴定管盛放;样品100.00mL,酸化后加入c1mol/L的Na2Cr2O7溶液 V1mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用4mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2mL,废水与K2Cr2O7溶液发生氧化还原反应,再用Fe2+把多余的Cr2O72-反应:
Cr2O72- + 6Fe2++14H+═2Cr3++6Fe3++7H2O,
1 6
n C2mol/L×V2×10-3L
n=![]() ×10-3mol,则100ml废水中,与废水反应的K2Cr2O7的物质的量=加入的K2Cr2O7的物质的量-与Fe2+反应的K2Cr2O7的物质的量=C1mol/L×V1×10-3L-
×10-3mol,则100ml废水中,与废水反应的K2Cr2O7的物质的量=加入的K2Cr2O7的物质的量-与Fe2+反应的K2Cr2O7的物质的量=C1mol/L×V1×10-3L-![]() ×10-3mol,1L废水水样中被还原的K2Cr2O7的物质的量=(C1V1-
×10-3mol,1L废水水样中被还原的K2Cr2O7的物质的量=(C1V1-![]() )×10-2mol,利用2K2Cr2O7~3O2可求出废水中化学耗氧量即COD,
)×10-2mol,利用2K2Cr2O7~3O2可求出废水中化学耗氧量即COD,
2K2Cr2O7 ~ 3O2
2 3×32
(C1V1-![]() )×10-2mol m
)×10-2mol m
m=(48C1V1-8C2V2)×10-2g=(480C1V1-80C2V2)mg,该水样的COD为(480C1V1-80C2V2)mg/L,故答案为:酸式;480C1V1-80C2V2。

 单元期中期末卷系列答案
单元期中期末卷系列答案