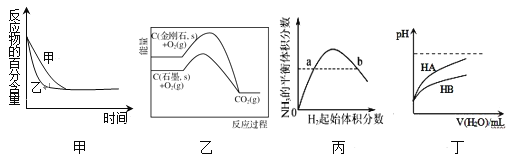
题目内容
【题目】下列物质中,物质的量最大的是________,含分子个数最多的是________,含原子个数最多的是________,质量最大的是________。
A.6 g H2;
B.0.5 mol CO2;
C.1.204×1024个HCl分子;
D.标准状况下33.6LCH4;
E.92 g乙醇(C2H5OH);
【答案】A A E E
【解析】
根据n=![]() =
=![]() =
=![]() ,结合物质的组成计算解答。
,结合物质的组成计算解答。
A、6g H2的物质的量为![]() =3mol,所含有分子数为3NA,原子数为6NA;
=3mol,所含有分子数为3NA,原子数为6NA;
B、0.5mol CO2所含有分子数为0.5NA,原子数为1.5NA,其质量为0.5mol×44g/mol=22g;
C、1.204×1024 个HCl 分子的物质的量为![]() =2mol,所含有分子数为2NA,原子数为4NA,其质量为2mol×36.5g/mol=73g;
=2mol,所含有分子数为2NA,原子数为4NA,其质量为2mol×36.5g/mol=73g;
D、标准状况下33.6LCH4的物质的量为![]() =1.5mol,所含有分子数为1.5NA,原子数为7.5NA,其质量为1.5mol×16g/mol=24g;
=1.5mol,所含有分子数为1.5NA,原子数为7.5NA,其质量为1.5mol×16g/mol=24g;
E、92g C2H5OH(乙醇)的物质的量为=![]() =2mol,所含有分子数为2NA,原子数为18NA;
=2mol,所含有分子数为2NA,原子数为18NA;
所以物质的量最大的是H2,含分子个数最多的是H2;含原子个数最多的是C2H5OH,质量最大的是C2H5OH,故答案为:A;A;E;E。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
【题目】某溶液中可能含有Cl-、SO42-、CO32+、Cu2+、Ba2+和Na+,探究小组为了确定该溶液中离子的组成,取该溶液100mL进行实验。
步骤 | 实验操作及现象 | 实验结论 | 判断理由 |
I | 加入过量NaOH溶液,生成蓝色沉淀 | 肯定有Cu2+,肯定无____ | 肯定无该离子的理由:_____________ |
II | 将生成的蓝色沉淀过滤、洗涤,灼烧得到24.0g黑色固体。 | Cu2+的物质的量浓度为__ | Cu元素守恒 |
III | 向Ⅱ所得滤液中加入足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的白色沉淀。 | 肯定有Cl-和__肯定无Ba2+ | 肯定有Cl-的理由:______________ |