题目内容
【题目】下图是某儿童微量元素体检报告单的部分数据:
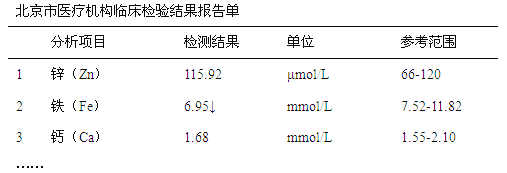
根据上表的数据,回答下列问题:
(1)该儿童__________元素含量偏低。
(2)报告单中“μmol/L”是___________(填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的_________(填“氧化性”或“还原性”)。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是___________________。
【答案】Fe 浓度 还原性 防止Fe2+被氧化
【解析】
(1)根据检验报告,铁元素含量低于参考范围的最低值;
(2)报告单中“μmol/L”是物质的量浓度的单位,质量单位是g等,体积单位是L、mL等;
(3)Fe3+→Fe2+化合价降低,被还原,则维生素C具有还原性;
(4)Fe2+容易被氧化成Fe3+,糖衣的目的是防止Fe2+被氧化。

练习册系列答案
相关题目