题目内容
18.正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
| 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是滴液漏斗,D仪器的名称是直形冷凝管.
(2)沸石的作用是防止暴沸.
(3)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)本实验中,正丁醛的产率为51%.
分析 (1)根据实验装置图可知仪器的名称;
(2)加入沸石的作用是防止暴沸;
(3)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(5)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O列方程计算;
解答 解:(1)根据实验装置图可知,B仪器的名称是滴液漏斗,D仪器的名称直形冷凝管,
故答案为:滴液漏斗;直形冷凝管;
(2)加入沸石的作用是防止暴沸,
故答案为:防止暴沸;
(3)正丁醛密度为0.8017 g•cm-3,小于水的密度,故分层水层在下方,
故答案为:下;
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(5)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=$\frac{74×2}{72×4}$×100%=51%,
故答案为:51.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.

练习册系列答案
相关题目
8.如图为离子晶体立体构型示意图:(●阳离子,○阴离子)以M代表阳离子,以N表示阴离子,写出各离子晶体的组成表达式不正确的是( )
| A. | 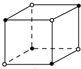 MN | B. |  MN3 | C. |  MN2 | D. |  MN3 |
6.氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
(1)请写出工业上由NH3制取NO的化学方程式4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$ 4NO+6H2O.
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
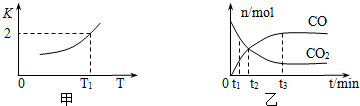
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$,平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$.
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定见表.
起始时乙容器中的压强是甲容器的0.8倍.
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
(1)请写出工业上由NH3制取NO的化学方程式4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$ 4NO+6H2O.
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.

①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$,平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$.
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定见表.
| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
13.青奥中心外墙的复合保温材料采用铝合金锁边.有关铝合金的性质正确的是( )(填字母).
| A. | 强度小 | B. | 耐腐蚀 | C. | 密度大 |
3.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | 绚丽缤纷的烟花与原子核外电子发生跃迁吸收能量有关 | |
| C. | 叶绿素、血红素和维生素B12都是配合物 | |
| D. | 当单一波长的X-射线通过石英玻璃时,在记录仪上可看到分立的斑点或谱线 |
10.下列化合物中含有2个手性碳原子的是( )
| A. | 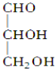 | B. | 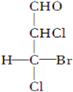 | C. | 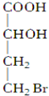 | D. | 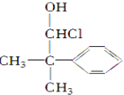 |
8.下列说法中,正确的是( )
| A. | 分离苯和水的混合物,可用分液法 | |
| B. | 从Na2CO3溶液中得到Na2C03,可用过滤法 | |
| C. | 分离酒精和CCl4的混合物,可用分液法 | |
| D. | 分离NaCl和AgCl的混合物,可用萃取法 |
 .
.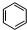 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$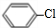 +HCl.
+HCl.