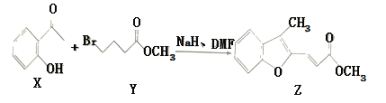
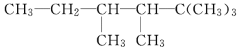题目内容
【题目】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程中H2S气体的逸出)。下列说法正确的是( )
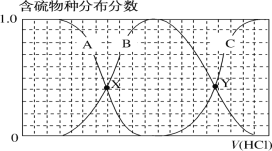
A.含硫物种B表示H2S
B.在滴加盐酸过程中,溶液中c(Na+)与含硫物种浓度的关系为c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
C.X、Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka1
D.NaHS溶液呈碱性,若向该溶液中加入CuSO4溶液,恰好完全反应时所得溶液呈强酸性,其原因是Cu2++HS-=CuS↓+H+
【答案】D
【解析】
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小,则A为S2-;B先增加后减少,则B为HS-;C开始时几乎不存在,之后逐渐增大,则C为H2S。
A.B先增加后减少,则B为HS-;C开始时几乎不存在,之后逐渐增大,则C为H2S,故A错误;
B.向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,若忽略滴加过程H2S气体的逸出,根据混合液Na、S物料守恒可得:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],故B错误;
C.X点为S2-和HS-浓度相同,K2(H2S)=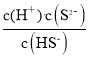 =c(H+),则由X点处的pH,可计算Ka2(H2S)的值,故C错误;
=c(H+),则由X点处的pH,可计算Ka2(H2S)的值,故C错误;
D.NaHS溶液中加入CuSO4溶液,硫化铜难溶于稀酸,发生反应:Cu2++HS-=CuS↓+H+,溶液显示强酸性,故D正确;
故选D。

【题目】下列各选项中,物质之间通过一步反应就能实现如图所示变化的是( )
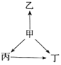
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D