题目内容
【题目】煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)在25℃、101kPa时,H2与O2化合生成1molH2O(g)放出241.8kJ的热量,其热化学方程式为______.
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+![]() O2(g)═CO2(g)△H=-283.0kJ/mol
O2(g)═CO2(g)△H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g)△H=______kJ/mol.
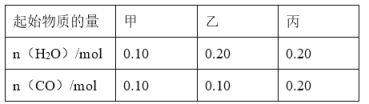
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.
①该反应的平衡常数表达式为______.
②平衡时,甲容器中CO的转化率是______;容器中CO的转化率:乙______甲;丙______甲.(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度______(填“升高”或“降低”).
【答案】![]() +131.3
+131.3 ![]() 50% > = 降低
50% > = 降低
【解析】
(1)根据热化学方程式的书写原则进行书写;
根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的计算;
(2)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
②令参加反应的CO的物质的量为x,根据三段式表示出平衡时各组分的物质的量,由于反应前后气体的体积不变,故用物质的量代替浓度代入平衡常数列方程计算;
乙与甲相比,乙中增大水的物质的量,平衡向正反应方向移动,CO的转化率增大;
丙与甲相比,乙中水、CO的物质的量为甲中的2倍,等效为在甲的基础上压强增大一倍,平衡不移动,转化率不变;
③通过改变温度,使CO的平衡转化率升高,则平衡向正反应方向移动,该反应正反应为放热反应,故应降低温度。
(1)已知:在25℃、101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为:![]() ;
;
答案为:![]() ;
;
设![]() 为反应③,已知:存在反应①和②,根据盖斯定律,①-③-②得
为反应③,已知:存在反应①和②,根据盖斯定律,①-③-②得![]() ;
;
故答案为:![]() ;+131.3;
;+131.3;
(2). ①按![]() ,可得到
,可得到![]() ;
;
答案为:![]() ;
;
②令参加反应的CO的物质的量为x,则:
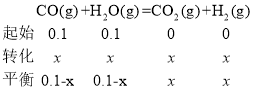 ;因为
;因为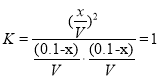 ,得x=0.05mol,故CO的转化率为
,得x=0.05mol,故CO的转化率为![]() ;
;
答案为:50%;
乙与甲相比,乙中增大水的物质的量,平衡向正反应方向移动,CO的转化率增大,故CO转化率:乙>甲;丙与甲相比,乙中水、CO的物质的量为甲中的2倍,等效为在甲的基础上压强增大一倍,平衡不移动,转化率不变,故CO转化率:甲=丙;
答案为:>; =;
③通过改变温度,使CO的平衡转化率升高,则平衡向正反应方向移动,该反应正反应为放热反应;故应降低温度;
答案为:降低。