题目内容
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+ . 将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质铁的质量是( )
A.2.24g
B.3.36g
C.5.60g
D.10.08g
【答案】C
【解析】解:完全反应后滤液中没有Cu2+ , 说明溶液中也没有Fe3+ , 则溶液中阳离子有Fe2+和H+ , 溶质为FeCl2和HCl,根据电荷守恒得2n(Fe2+)+n(H+)=n(Cl﹣),则n(Fe2+)= ![]() mol=0.18mol,生成n(H2)=
mol=0.18mol,生成n(H2)= ![]() =0.04mol,因为还有盐酸剩余,溶液残留固体是Cu,n(Cu)=
=0.04mol,因为还有盐酸剩余,溶液残留固体是Cu,n(Cu)= ![]() =0.02mol,
=0.02mol,
设Fe的物质的量为xmol、Fe2O3的物质的量为ymol,
根据Fe原子守恒得x+2y=0.18
根据转移电子守恒得2x=0.04×2+0.02×2+2y×1,
解得x=0.10、y=0.04,
所以m(Fe)=0.10mol×56g/mol=5.60g,
故选C.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。
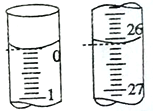
(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
