��Ŀ����
����Ŀ���Թ��ȸʯ[��Ҫ�ɷ�Ϊ CuCO3Cu��OH��2��CuSiO32H2O���� SiO2��FeCO3��Fe2O3������]Ϊԭ���Ʊ�CuCl2�Ĺ����������£� 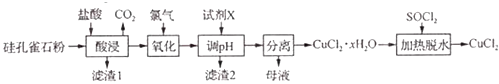
��֪��SOCl2+H2O ![]() SO2��+2HCl��
SO2��+2HCl��
��1���������ʱ������CuCO3Cu��OH��2��Ӧ�Ļ�ѧ����ʽΪ �� Ϊ��ߡ������ʱͭԪ�صĽ����ʣ����Բ�ȡ�Ĵ�ʩ�У����ʵ��������Ũ�ȣ����ʵ���߷�Ӧ�¶ȣ��� ��
��2������2����Ҫ�ɷ�Ϊ���ѧʽ����
��3����������ʱ������Ӧ�����ӷ���ʽΪ ��
��4���Լ�X�������ǵ�����Һ��PH���Լ�X������
A��CuSO4 B��Cu2��OH��2CO3 C��NaOH D��CuO
����pH��ʱ��PH���ܹ��ߣ���ԭ���� ��
��5����������ˮ��ʱ������SOCl2��Ŀ���� ��
���𰸡�
��1��CuCO3?Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O���ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ��
��2��Fe��OH��3
��3��Cl2+2Fe2+�T2Fe3++2Cl��
��4��BD����ֹCu2+ת��ΪCu��OH��2����
��5�����ɵ�HCl����CuCl2��ˮ��
���������⣺��1���������ʱ������CuCO3Cu��OH��2��ӦΪ���ֽⷴӦ���ɴ�ȷ��������ƽ�û�ѧ����ʽΪCuCO3Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O��Ϊ��ߡ������ʱͭԪ�صĽ����ʣ��ɣ����ʵ��������Ũ�ȣ����ʵ���߷�Ӧ�¶ȣ����ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ�䣬
���Դ��ǣ�CuCO3Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O���ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ�䣻
��2.����������ͼ������������Һ����������ҪΪCu2+��Fe3+ �� ���Լ�X����pHʹFe3+��ȫ��������ȥ������2ΪFe��OH��3 ��
���Դ��ǣ�Fe��OH��3��
��3.�����ȸʯ��Ҫ�ɷ�ΪCuCO3Cu��OH��2��CuSiO32H2O����SiO2��FeCO3��Fe2O3�����ʣ���������ͼ�������ᡰ���������Һ��ֻ��Fe2+�ɱ�������������������ʱ������Ӧ�����ӷ���ʽΪCl2+2Fe2+�T2Fe3++2Cl�� ��
���Դ��ǣ�Cl2+2Fe2+�T2Fe3++2Cl����
��4.����������ͼ������������Һ����������ҪΪCu2+��Fe3+ �� ���Լ�X����pHʹFe3+��ȫ��������ȥ��Cu2+��������Һ�У�ʵ��Cu2+��Fe3+�ķ��룬�����Ʊ�CuCl2���Լ�Xѡ��
A��CuSO4 ���ܵ�����ҺPH������������������ӣ���A����
B��Cu2��OH��2CO3 ���ᷴӦ���Ե�����ҺPH�Ҳ��������ʣ���B��ȷ��
C��NaOH���Ե�����ҺPH�������������������ʣ���C����
D��CuO���Ժ��ᷴӦ������ҺPH�������������ʣ���D��ȷ��
ѡBD
����pH��ʱ��pH���ܹ��ߣ�����Cu2+ת��ΪCu��OH��2������
���Դ��ǣ�BD����ֹCu2+ת��ΪCu��OH��2��������5������֪��SOCl2+H2O ![]() SO2��+2HCl������������ˮ��ʱ������SOCl2��Ŀ�������ɵ�HCl����CuCl2��ˮ�⣬
SO2��+2HCl������������ˮ��ʱ������SOCl2��Ŀ�������ɵ�HCl����CuCl2��ˮ�⣬
���Դ��ǣ����ɵ�HCl����CuCl2��ˮ�⣮

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�����Ŀ��Ϊ�����ú�������ʣ������Ȱ�úת��ΪCO��H2���ٽ�����ת��Ϊ�״���ijʵ����Ա��һ���¶��µ��ܱ������У�����һ������H2��CO��������Ӧ:
2H2(g)+CO(g)![]() CH3OH(g)���ⶨ�IJ���ʵ����������:
CH3OH(g)���ⶨ�IJ���ʵ����������:
t/s | 0 | 500 | 1 000 |
c(H2)/(mol��L-1) | 5.00 | 3.52 | 2.48 |
c(CO)/(mol��L-1) | 2.50 |
(1)��500 s����H2��ʾ�Ļ�ѧ��Ӧ��������������
(2)��1 000 s����CO��ʾ�Ļ�ѧ��Ӧ��������������1 000 sʱCO��ת��������������
(3)��500 sʱ���ɵļ״���Ũ������������
