题目内容
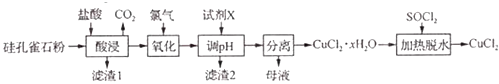
【题目】如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:
N2(g)+3H2(g)2NH3(g)△H=﹣192kJmol﹣1 . 向 M、N 中,都通入 xmol N2 和ymol H2的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )![]()
A.若x:y=1;2,则平衡时,M中的转化率:N2>H2
B.若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90%
C.若x=1,y=3,则达到平衡时反应物的转化率N>M
D.平衡时N2气体在两容器中体积分数可能相等
【答案】C,D
【解析】解:M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、x:y=1:2,即y=2 x,设反应中消耗掉amoN2l,则:
N2(g) | + | 3H2(g) | 2NH3(g | ||
初始: | x | 2x | 0 | ||
变化: | a | 3a | 2a |
故N2的转化率= ![]() ,H2的转化率=
,H2的转化率= ![]() ,则平衡时,M中的转化率:N2<H2 , 故A错误;
,则平衡时,M中的转化率:N2<H2 , 故A错误;
B、题目中热化学方程式的意义:若1moN2l完全反应,放热192 kJ,当M中放出热量172.8 kJ时,参加反应的N2的物质的量为 ![]() ×1mol=0.9mol,故N2的转化率为
×1mol=0.9mol,故N2的转化率为 ![]() ,故B错误;
,故B错误;
C、x=1,y=3,由于反应后气体体积减小,N容器建立的平衡相当于恒温恒容下建立的平衡减小容器体积,压强增大,平衡正向移动,达到平衡后的转化率关系为:α(M)<α(N),故C正确;
D、要让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,则:
N2(g) | + | 3H2(g) | 2NH3(g | ||
起始: | x | y | 0 | ||
反应: | z | 3z | 2z | ||
平衡: | x﹣z | y﹣3z | 2z |
故平衡时N2的体积分数为 ![]() ,N2的体积分数始终为定值,则x=y,即x=y时,平衡时N2气体在两容器中体积分数相等,故D正确;
,N2的体积分数始终为定值,则x=y,即x=y时,平衡时N2气体在两容器中体积分数相等,故D正确;
故选CD.
【考点精析】认真审题,首先需要了解等效平衡(在条件不变时,可逆反应不论采取何种途径,即由正反应开始或由逆反应开始,最后所处的平衡状态是相同;一次投料或分步投料,最后所处平衡状态是相同的,某一可逆反应的平衡状态只与反应条件(物质的量浓度、温度、压强或体积)有关,而与反应途径(正向或逆向)无关).