题目内容
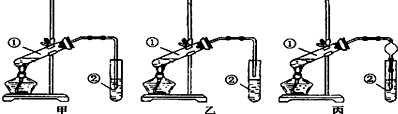
13.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用左图1所示装置模拟工业制取并收集ClO2.
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:2KClO3+H2C2O4$\frac{\underline{\;60°\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O.
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、温度计;B也必须添加温度控制装置,应该是冰水浴(选填“冰水浴”或“热水浴”)装置.
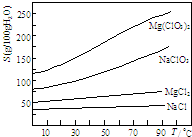
(3)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2•3H2O,在温度高于38℃时析出晶体是NaClO2.根据如图2所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①蒸发结晶;②趁热过滤;③洗涤;④干燥.
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol•L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.(已知2Na2S2O3+I2=Na2S4O6+2NaI)
①滴定过程中,至少须进行两次平行测定的原因是减少实验误差.
②原ClO2溶液的浓度为$\frac{135c{V}_{2}}{{V}_{1}}$g/L(用步骤中的字母代数式表示).
分析 (1)根据反应物和产物结合原子守恒来书写方程式,
(2)让反应物充分的接触;测量温度的仪器是温度计,二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行;
(3)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(4)①多次实验可以减少误差;
②多次实验可以减少误差,根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
解答 解:(1)加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水,反应方程式为:2KClO3+H2C2O4$\frac{\underline{\;60°\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O,
故答案为:2KClO3+H2C2O4$\frac{\underline{\;60°\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;
(2)让反应物充分的接触,加快反应速率反应时搅拌,A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯,测量温度的仪器是温度计,二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行,所以应该采用冰水浴,
故答案为:温度计;冰水浴;
(3)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,
故答案为:蒸发结晶;趁热过滤;
(4)①为减少实验误差,应采用多次实验的方法,取平均值,减少计算误差,
故答案为:减少实验误差;
③设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{1{0}^{-2}x×{V}_{1}×1{0}^{-3}}{1{0}^{-1}}$mol 1×10-3cV2mol
x=$\frac{2c{V}_{2}}{{V}_{1}}$mol•L-1=$\frac{135c{V}_{2}}{{V}_{1}}$g•L-1,
故答案为:$\frac{135c{V}_{2}}{{V}_{1}}$.
点评 本题考查实验方案的设计,同时考查学生分析问题、解决问题的能力,明确物质的性质是解本题关键,难度较大.

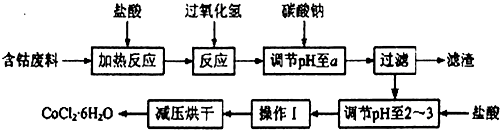
已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,)
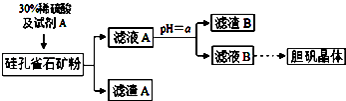
部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入绿色氧化剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)可向滤液A中加入bd(填字母)调节PH以除去杂质
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O
c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.
| A. | 除去乙酸乙酯中少量的乙酸:加入少量乙醇,将其转化为乙酸乙酯 | |
| B. | 除去Fe(OH)3胶体中的NaCl:用水溶解后过滤 | |
| C. | 除去苯中的苯酚:加入浓溴水后过滤 | |
| D. | 除去溴乙烷中的溴:加入Na2S03溶液再分液 |

 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: