题目内容
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。
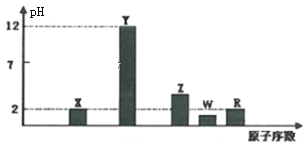
(1)元素R在周期表中的位置是_______;元素Z的原子结构示意图是________。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是__________(填序号)
A. S与H2发生化合反应比C与H2化合更容易
B. 酸性:H2SO3 >H2CO3
C. CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为_________。
②它们+4价氢氧化物的碱性由强到弱顺序为____________(填化学式)。
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。羰基硫(COS)的电子式为:______________________。
【答案】第三周期ⅦA族  离子键、共价键(或非极性共价键) AC 32 Pb(OH)4>Sn(OH)4>Ge(OH)4
离子键、共价键(或非极性共价键) AC 32 Pb(OH)4>Sn(OH)4>Ge(OH)4 ![]()
【解析】
I.X、Y、Z、W、R的原子序数依次增大,最高价氧化物对应水化物溶液浓度均为0.01molL-1,Y的pH为12,为一元强碱,则Y是Na元素,X、R的pH均为2,为一元强酸,则X为N元素、R为Cl元素;W的pH小于2,则为二元强酸,故W为S元素;Z的pH大于2,为弱酸,则Z为P元素;据此分析解答;
Ⅱ.(1)根据元素非金属性强弱的判断方法分析判断;
(2)①Ge处于第四周期第IVA族,同主族相邻元素原子序数相差第四周期容纳元素的种数,据此分析计算;②金属性越强,最高价氧化物对应水化物的碱性越强,据此排序;
(3)COS与CO2相似,则COS中C原子分别与O原子、S原子之间形成2对共用电子对。
I.根据上述分析,X为N元素,Y是Na元素,Z为P元素,W为S元素,R为Cl元素。
(1)元素R为Cl,在周期表中位于第三周期ⅦA族。元素Z为P元素,原子结构示意图为: ,故答案为:第三周期ⅦA族;
,故答案为:第三周期ⅦA族; ;
;
(2)元素Y和W形成的Y2W2型化合物为Na2S2,其中含有的化学键类型为:离子键和共价键,故答案为:离子键、共价键(或非极性共价键);
Ⅱ.(1)A.S与H2发生化合反应比C与H2化合更容易,说明S的非金属性更强,故A正确;B.H2SO3不是S的最高价含氧酸,不能根据酸性:H2SO3 >H2CO3判断中心元素C和S的非金属性强弱,故B错误;C.CS2中碳元素为+4价,硫元素为-2价,说明S元素对键合电子吸引能力更强,则S的非金属性更强,故C正确;故答案为:AC;
(2)①Ge处于第四周期第IVA族,同主族相邻元素原子序数相差第四周期容纳元素的种数,故Ge的原子序数为14+18=32,故答案为:32;
②金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:Pb(OH)4>Sn(OH)4>Ge(OH)4,故答案为:Pb(OH)4>Sn(OH)4>Ge(OH)4;
(3)COS与CO2相似,则COS中C原子分别与O原子、S原子之间形成2对共用电子对,羰基硫(COS)的电子式为![]() ,故答案为:
,故答案为:![]() 。
。