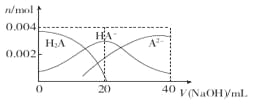
题目内容
【题目】已知H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
A.H2的燃烧热为241.8 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
【答案】A
【解析】
A.燃烧热指101kPa,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,H的稳定氧化物为H2O(l),所以A不正确,
B.反应热和化学计量数成正比,B正确;
C.气态水的能量高于液态水的能量,所以1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ,C正确;
D.根据热化学方程式知,断开1molH2和0.5molO2中化学键吸收的能量小于形成1molH2O中化学键释放的能量,则断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量,D正确;
答案选A。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】废旧锂离子电池的正极材料试样![]() 主要含有
主要含有![]() 及少量Al、Fe等
及少量Al、Fe等![]() 可通过下列实验方法回收钴、锂.
可通过下列实验方法回收钴、锂.
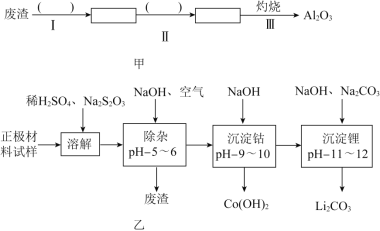
(1)在上述溶解过程中,![]() 被氧化成
被氧化成![]() ,
,![]() 在溶解过程中反应的离子方程式为 ______ .
在溶解过程中反应的离子方程式为 ______ .
沉淀物 | 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
(2)除杂时通入空气的目的 ______ ,所得的废渣成分为 ______ ![]() 从废渣中获得
从废渣中获得![]() 的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
(3)工业上,将![]() 粗品制备成高纯
粗品制备成高纯![]() 的部分工艺如图乙.
的部分工艺如图乙.
![]() 将
将![]() 溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
![]() 电解后向LiOH溶液中加入过量
电解后向LiOH溶液中加入过量![]() 溶液,过滤、烘干得高纯
溶液,过滤、烘干得高纯![]() .
.
①![]() 中,阴极的电极反应式是 ______ .
中,阴极的电极反应式是 ______ .
②![]() 中,生成
中,生成![]() 反应的化学方程式是 ______ .
反应的化学方程式是 ______ .