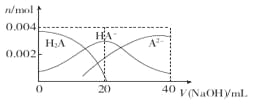
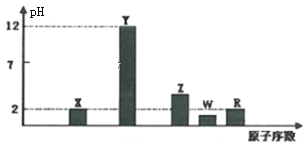
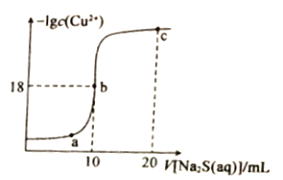
题目内容
【题目】请按照下列要求回答问题:
(1)电解氯化钠溶液的化学方程式:__________________________________。
(2)0.1 mol/L 的碳酸钠溶液中离子浓度由大到小顺序为:__________________________。
(3)浓的 Al2(SO4)3 溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理__________________________。
(4)将25℃下 pH=12 的 Ba(OH)2 溶液aL与 pH=1的HCl溶液bL 混合,若所得混合液为中性,则 a:b= __________________________。(溶液体积变化忽略不计)。
(5)pH=3 的 NH4Cl 溶液,由水电离出的 c(H+)= __________________________。
(6)常温时,Fe(OH)3 的溶度积常数 Ksp=1×10-38,要使溶液中的 Fe3+沉淀完全(残留的 c(Fe3+)<10-5 mol·L-1),则 溶液的 pH 应大于____________________________。
【答案】2NaCl+2H2O ![]() Cl2↑+2NaOH+H2↑ c(Na+) >c(CO32-) >c(OH-) >c(HCO3-) >c(H+) Al3++3HCO3--=Al(OH)3↓+3CO2↑ 10:1 1×10-3mol/L 3
Cl2↑+2NaOH+H2↑ c(Na+) >c(CO32-) >c(OH-) >c(HCO3-) >c(H+) Al3++3HCO3--=Al(OH)3↓+3CO2↑ 10:1 1×10-3mol/L 3
【解析】
(1)电解氯化钠溶液的化学方程式:![]() ;
;
(2)Na2CO3溶液中CO32-水解呈碱性,以此判断溶液中离子浓度大小;
(3)Al2(SO4)3 溶液和小苏打(NaHCO3)发生双水解反应;
(4)通过氢离子浓度和氢氧根浓度和水的离子积常数计算体积比;
(5)NH4Cl 溶液中水电离出的 c(H+)等于溶液中氢离子浓度;
(6)通过KSP计算OH-浓度,再利用水的离子积常数计算H+浓度。
(1)电解氯化钠溶液的化学方程式:![]() ,故答案为:
,故答案为:![]() ;
;
(2)Na2CO3溶液中存在:![]() ;则
;则![]() ,故答案为:
,故答案为:![]() ;
;
(3)Al2(SO4)3 溶液和 (NaHCO3)发生双水解反应生成氢氧化铝和二氧化碳,离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)25℃时,![]() ,则pH=12 的 Ba(OH)2溶液c(OH-)=0.01mol·L-1, pH=1的HCl溶液c(H+)=0.1mol·L-1,若所得混合液为中性,则a×c(OH-)=b×c(H+),解得a:b=10:1;
,则pH=12 的 Ba(OH)2溶液c(OH-)=0.01mol·L-1, pH=1的HCl溶液c(H+)=0.1mol·L-1,若所得混合液为中性,则a×c(OH-)=b×c(H+),解得a:b=10:1;
故答案为:10:1;
(5)NH4Cl 溶液中水电离出的 c(H+)等于溶液中氢离子浓度)pH=3,则c(H+)=10-3mol·L-1;
故答案为:1×10-3mol/L;
(6)常温时,Fe(OH)3 的溶度积常数KSP=c3(OH-)×c(Fe3+)=1×10-38, c(Fe3+)<10-5 mol·L-1,则c3(OH-)> ![]() =
=![]() =10-33,所以c(OH-)>10-11mol/L,所以pH应大于3;
=10-33,所以c(OH-)>10-11mol/L,所以pH应大于3;
故答案为:3。

【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |
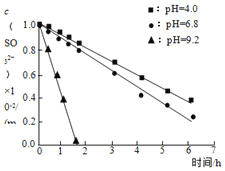
A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同