题目内容
7.(1)3.01×1022个OH-的物质的量为0.05 mol,含有质子的物质的量为0.45 mol,这些OH-与0.05mol NH3的质量相同.(2)20.4g Al2X3中含有0.4mol Al3+,则Al2X3的摩尔质量是102g/mol,X的相对原子质量是16.
(3)小明同学左手手中有一瓶溶液体积为1L的氯化钙溶液,右手手中有一瓶体积为33.6L氯化氢气体.已知氯化钙溶液中含有80克的Ca2+,则这瓶溶液中氯离子的浓度为4mol/L;若右手手中的气体处于标准状况下,则氯化氢的质量为54.75g;现小明在一定条件下将右手手中的氯化氢气体(标况下)完全溶解到氯化钙溶液中,则溶解气体后溶液中的氯离子浓度为5.5mol/L(假设气体溶解前后溶液体积不变).
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算OH-的物质的量,根据m=nM计算质量;1个OH-含有9个质子、10个电子;
(2)1molAl2X3中含有2mol的Al3+,所以含有0.4mol Al3+,Al2X3的物质的量为0.2mol,根据M=$\frac{m}{n}$来计算;
(3)根据c=$\frac{n}{V}$,n=$\frac{V}{{V}_{m}}$,氯离子的浓度根据c═$\frac{n}{V}$计算求解.
解答 解:(1)3.01×1022个OH-的物质的量=$\frac{3.01×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.05mol,1个OH-含有9个质子,含有质子的物质的量=0.05mol×9=0.45mol,m(OH-)=0.05mol×17g/mol=0.85g,n(NH3)=$\frac{0.85g}{17g/mol}$=0.05mol,故答案为:0.05;0.45;0.05;
(2)1molAl2X3中含有2mol的Al3+,所以含有0.4mol Al3+,Al2X3的物质的量为0.2mol,M=$\frac{m}{n}$=$\frac{20.4g}{0.2mol}$=102g/mol,X的相对原子质量为$\frac{102-27×2}{3}$=16,
故答案为:102g/mol;16;
(3)氯化钙溶液中含有80克的Ca2+,所以氯化钙的物质的量为:$\frac{80}{40}$=2mol,氯化钙的物质的量浓度为:c=$\frac{n}{V}$=$\frac{2mol}{1L}$=2mol/L,所以氯离子的浓度为4mol/L,n=$\frac{V}{{V}_{m}}$=$\frac{33.6L}{22.4L/mol}$=1.5mol,所以质量1.5mol×36.5g/mol=54.75g,氯离子的浓度c═$\frac{4×1+1.5}{1}$=5.5mol•L-1,
故答案为:4;54.75;5.5.
点评 本题考查溶液浓度计算,涉及质量分数、物质的量浓度计算,难度不大,注意理解物质的量浓度与质量分数之间的关系.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
其中有效措施是( )
| A. | ①②③ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |
①Cl- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg.
| A. | ①⑦ | B. | ②④ | C. | ③⑤⑥ | D. | ②④⑤⑥ |
| A. | 氢氧化钡溶液与稀硫酸的反应:OH-+H+=H2O | |
| B. | 澄清的石灰水与稀醋酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 在Ca(HCO3)2溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 往澄清石灰水通入过量二氧化碳气体:CO2+OH-=HCO3- |
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2S ⑦SO2 ⑧CS2 ⑨H2O ⑩HF.
| A. | ②③④⑤⑧ | B. | ①③④⑤⑧ | C. | ①③④⑧ | D. | 以上均不对 |
| A. | 体积一定相等 | B. | 分子数一定相等 | ||
| C. | 质量一定相等 | D. | 物质的量一定相等 |
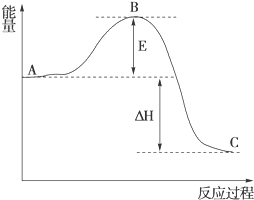 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.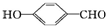 的沸点比
的沸点比 高,原因
高,原因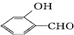 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.