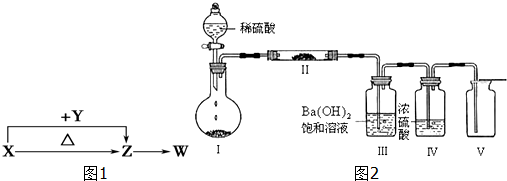
题目内容
19.(1)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、范德华力.(2)
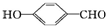 的沸点比
的沸点比 高,原因
高,原因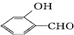 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.(3)H+可与H2O形成H3O+,H3O+中O子采用sp3杂化.
分析 (1)化学键的键能大于氢键的键能,氢键的键能大于分子间作用力;
(2)氢键对物质的物理性质产生影响,分子间氢键使物质的沸点升高,分子内氢键使物质的沸点降低;
(3)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型.
解答 解:(1)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力,
故答案为:O-H键、氢键、范德华力;
(2)含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键,
故答案为: 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(3)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.故答案为:sp3.
点评 本题把物质结构和性质与有机化合物的性质融合成一体,考查学生对元素推理、原子轨道杂化类型、分子空间结构、氢键等知识的掌握和应用能力.本题基础性较强,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.可以用分液漏斗分离的一组化合物是( )
| A. | 硝基苯和水 | B. | 苯和溴苯 | C. | 酒精和水 | D. | 溴和四氯化碳 |
4.配制480mL 0.5mol•L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、胶头滴管、500 mL容量瓶等.
(2)计算:需要NaOH固体的质量为10.0 g.
(3)称量:①称量过程中NaOH固体应放于小烧杯中并放在天平的左盘(填“左盘”或“右盘”).
②某学生先用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,说明此时左边质量小于(填“大于”或“小于”)右边.假定最终称得小烧杯的质量为32.6 g(填“32.6g”或“32.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在下图中标尺上画出游码的位置(画“△”表示).
标尺:

(4)溶解、冷却,该步实验中需要使用玻璃棒,作用是搅拌加速溶解.
(5)转移、洗涤.在转移时应使用玻璃棒引流,洗涤烧杯2次~3次是为了保证溶质全部转移至容量瓶中.
(6)定容、摇匀.定容的操作是向容量瓶中加入蒸馏水至距刻度线1 cm~2 cm时,改用胶头滴管滴加蒸馏水至液体的凹液面最低处和刻度线相切.
(7)某学生实际配制NaOH溶液的浓度为0.48mol•L-1,原因可能是A、C(填字母).
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤.
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、胶头滴管、500 mL容量瓶等.
(2)计算:需要NaOH固体的质量为10.0 g.
(3)称量:①称量过程中NaOH固体应放于小烧杯中并放在天平的左盘(填“左盘”或“右盘”).
②某学生先用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,说明此时左边质量小于(填“大于”或“小于”)右边.假定最终称得小烧杯的质量为32.6 g(填“32.6g”或“32.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在下图中标尺上画出游码的位置(画“△”表示).
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |

(4)溶解、冷却,该步实验中需要使用玻璃棒,作用是搅拌加速溶解.
(5)转移、洗涤.在转移时应使用玻璃棒引流,洗涤烧杯2次~3次是为了保证溶质全部转移至容量瓶中.
(6)定容、摇匀.定容的操作是向容量瓶中加入蒸馏水至距刻度线1 cm~2 cm时,改用胶头滴管滴加蒸馏水至液体的凹液面最低处和刻度线相切.
(7)某学生实际配制NaOH溶液的浓度为0.48mol•L-1,原因可能是A、C(填字母).
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤.
8.下列有关物质分类或归类正确的一组是
①液氨、液氯、干冰、碘化银均为化合物
②氢氟酸、盐酸、纯碱、氨水均为混合物
③明矾、小苏打、醋酸、次氯酸均为电解质
④烟、云、雾、豆浆均为胶体
⑤Na2O2、Na2CO3、NaHCO3、Na2SiO3均为钠盐
⑥NaCl、Na2CO3、NaHSO4、NaF均为正盐( )
①液氨、液氯、干冰、碘化银均为化合物
②氢氟酸、盐酸、纯碱、氨水均为混合物
③明矾、小苏打、醋酸、次氯酸均为电解质
④烟、云、雾、豆浆均为胶体
⑤Na2O2、Na2CO3、NaHCO3、Na2SiO3均为钠盐
⑥NaCl、Na2CO3、NaHSO4、NaF均为正盐( )
| A. | ①和② | B. | ②和③ | C. | ③和④ | D. | ②③⑥ |
9.下列有关胶体的叙述中不正确的是( )
| A. | 溶液、胶体、浊液最本质区别是分散质粒子直径的大小 | |
| B. | “雨后彩虹”既是一种自然现象又是光学现象,同时也与胶体有关 | |
| C. | 在溶有1mol Fe(OH)3的胶体中,含有NA个Fe(OH)3胶粒 | |
| D. | 分散质粒子大小介于1~100nm之间的分散系称为胶体 |
 .
.