题目内容
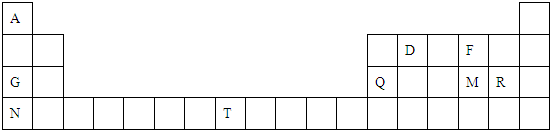
具有相同电子层结构的三种微粒An+、Bn-、C,下列分析正确的是( )
分析:An+、Bn-、C具有相同的电子层结构,则C原子一定具有稳定结构,即为稀有气体元素中的一种,由An+、Bn-的电子层结构再转化为原子结构可知,A必定在C(即稀有气体)的后面,B必定在C的前面〔称为“阴前阳下”(第一周期除外)〕,故A、B、C的原子序数关系为A>C>B,以此解答该题.
解答:解:设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数则为Z-n,则原子序数为A>C>B,故A错误;
B.因An+、Bn-具有相同的电子层结构,阴离子半径大于阳离子半径,即Bn->An+,故B错误;
C.An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构相同于An+、Bn-,所以C必为稀有气体元素的原子,故C正确;
D.B、C为同一周期的元素,而A应处于B、C下一周期的左半部,故A的原子半径应大于B,故D错误.
故选C.
B.因An+、Bn-具有相同的电子层结构,阴离子半径大于阳离子半径,即Bn->An+,故B错误;
C.An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构相同于An+、Bn-,所以C必为稀有气体元素的原子,故C正确;
D.B、C为同一周期的元素,而A应处于B、C下一周期的左半部,故A的原子半径应大于B,故D错误.
故选C.
点评:本题考查原子结构与元素周期律,此类题目首先要根据题给信息,确定各元素在周期表中的相对位置,然后根据元素周期律加以对照,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目