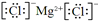题目内容
下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素.请用所给元素回答下列问题.
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 ;与Ar原子具有相同电子层结构的简单离子中半径由大到小的顺序是(用离子符号表示) .
(2)M、D两种元素形成的化合物含有的化学键类型是 ,分子的电子式为: ;
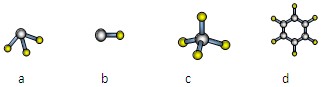
A与D形成分子的空间结构可能是如图1的(填序号) .
(3)保存T元素的二价硫酸盐需采取的措施是和理由是 ;所给元素中组成合适的反应物,用离子方程式表明元素M、R的非金属性强弱 .
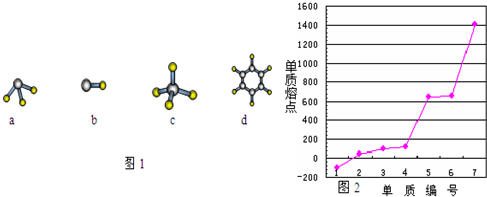
(4)第三周期主族元素(零族除外)单质熔点高低的顺序如图2所示,“1”所代表物质的化学式是 ,“7”所对应的元素形成最高价氧化物的化学式是 .
| A | |||||||||||||||||
| D | E | ||||||||||||||||
| G | Q | M | R | ||||||||||||||
| T | |||||||||||||||||
(2)M、D两种元素形成的化合物含有的化学键类型是
A与D形成分子的空间结构可能是如图1的(填序号)

(3)保存T元素的二价硫酸盐需采取的措施是和理由是
(4)第三周期主族元素(零族除外)单质熔点高低的顺序如图2所示,“1”所代表物质的化学式是
分析:根据元素在周期表中的位置知,A、D、E、G、Q、M、R、T分别是H、C、N、Na、Si、S、Cl、Fe元素,
(1)某元素原子的核外电子层数是最外层电子数的3倍,说明该元素的最外层电子数小于电子层数,且核外电子层数为最外层的3倍,符合条件的元素是Na元素;
Ar原子核外有18个电子,电子层结构相同的离子中,离子半径随着原子序数的增大而减小;
(2)S、C两种元素形成的化合物是二硫化碳,不同非金属元素之间易形成极性共价键,二硫化碳分子结构和二氧化碳相似,为非极性分子,每个硫原子与碳原子形成两个共价键;
A与D形成分子有甲烷、苯、乙烯、乙炔等;
(3)T元素的二价硫酸盐是硫酸亚铁,硫酸亚铁属于强酸弱碱盐,亚铁离子易水解生成氢氧化亚铁,亚铁离子不稳定,易被空气氧化生成铁离子;
M是S元素,R是Cl元素,可以根据二者单质的置换反应确定元素的非金属性强弱;
(4)单质的熔点与晶体类型有关,原子晶体熔点最高,其次是原子晶体,最小的是分子晶体,分子晶体中常温下为气态的其熔点最小.
(1)某元素原子的核外电子层数是最外层电子数的3倍,说明该元素的最外层电子数小于电子层数,且核外电子层数为最外层的3倍,符合条件的元素是Na元素;
Ar原子核外有18个电子,电子层结构相同的离子中,离子半径随着原子序数的增大而减小;
(2)S、C两种元素形成的化合物是二硫化碳,不同非金属元素之间易形成极性共价键,二硫化碳分子结构和二氧化碳相似,为非极性分子,每个硫原子与碳原子形成两个共价键;
A与D形成分子有甲烷、苯、乙烯、乙炔等;
(3)T元素的二价硫酸盐是硫酸亚铁,硫酸亚铁属于强酸弱碱盐,亚铁离子易水解生成氢氧化亚铁,亚铁离子不稳定,易被空气氧化生成铁离子;
M是S元素,R是Cl元素,可以根据二者单质的置换反应确定元素的非金属性强弱;
(4)单质的熔点与晶体类型有关,原子晶体熔点最高,其次是原子晶体,最小的是分子晶体,分子晶体中常温下为气态的其熔点最小.
解答:解:根据元素在周期表中的位置知,A、D、E、G、Q、M、R、T分别是H、C、N、Na、Si、S、Cl、Fe元素,
(1)某元素原子的核外电子层数是最外层电子数的3倍,说明该元素的最外层电子数小于电子层数,且核外电子层数为最外层的3倍,符合条件的元素是Na元素,钠原子核外有11个电子,有3个电子层,最外层有1个电子,属于其原子结构示意图为: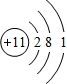 ;
;
Ar原子核外有18个电子,电子层结构相同的离子中,离子半径随着原子序数的增大而减小,与氩原子电子层结构相同的简单离子半径大小顺序是S 2->Cl-,
故答案为: ;S 2->Cl-;
;S 2->Cl-;
(2)S、C两种元素形成的化合物是二硫化碳,不同非金属元素之间易形成极性共价键,所以二硫化碳分子中存在极性共价键,二硫化碳分子结构和二氧化碳相似,为每个硫原子与碳原子形成两个共价键,所以二硫化碳的电子式为,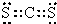 ;
;
A与D形成分子有甲烷、苯、乙烯、乙炔等,甲烷属于正四面体结构,苯的结构为平面正六边形,故选cd;
故答案为:极性共价键;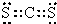 ;c、d;
;c、d;
(3)T元素的二价硫酸盐是硫酸亚铁,硫酸亚铁属于强酸弱碱盐,亚铁离子易水解生成氢氧化亚铁,亚铁离子不稳定,易被空气氧化生成铁离子,为防止亚铁离子水解和被氧化,稀释硫酸亚铁时要想硫酸亚铁溶液中加入稀硫酸和铁粉;
M是S元素,R是Cl元素,可以根据二者单质的置换反应确定元素的非金属性强弱,氯气能置换出氢硫酸中的硫单质,离子方程式为H2S+Cl2=2 H++2Cl-+S↓,
故答案为:加少量稀硫酸防止Fe2+水解,加少量铁粉(或铁钉)防止Fe2+氧化;H2S+Cl2=2 H++2Cl-+S↓;
(4)单质的熔点与晶体类型有关,原子晶体熔点最高,其次是原子晶体,最小的是分子晶体,分子晶体中常温下为气态的其熔点最小,属于熔点最小的是氯气,最高的是Si,硅形成的氧化物是二氧化硅,
故答案为:Cl2;SiO2.
(1)某元素原子的核外电子层数是最外层电子数的3倍,说明该元素的最外层电子数小于电子层数,且核外电子层数为最外层的3倍,符合条件的元素是Na元素,钠原子核外有11个电子,有3个电子层,最外层有1个电子,属于其原子结构示意图为:
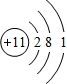 ;
;Ar原子核外有18个电子,电子层结构相同的离子中,离子半径随着原子序数的增大而减小,与氩原子电子层结构相同的简单离子半径大小顺序是S 2->Cl-,
故答案为:
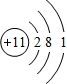 ;S 2->Cl-;
;S 2->Cl-;(2)S、C两种元素形成的化合物是二硫化碳,不同非金属元素之间易形成极性共价键,所以二硫化碳分子中存在极性共价键,二硫化碳分子结构和二氧化碳相似,为每个硫原子与碳原子形成两个共价键,所以二硫化碳的电子式为,
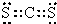 ;
;A与D形成分子有甲烷、苯、乙烯、乙炔等,甲烷属于正四面体结构,苯的结构为平面正六边形,故选cd;
故答案为:极性共价键;
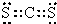 ;c、d;
;c、d;(3)T元素的二价硫酸盐是硫酸亚铁,硫酸亚铁属于强酸弱碱盐,亚铁离子易水解生成氢氧化亚铁,亚铁离子不稳定,易被空气氧化生成铁离子,为防止亚铁离子水解和被氧化,稀释硫酸亚铁时要想硫酸亚铁溶液中加入稀硫酸和铁粉;
M是S元素,R是Cl元素,可以根据二者单质的置换反应确定元素的非金属性强弱,氯气能置换出氢硫酸中的硫单质,离子方程式为H2S+Cl2=2 H++2Cl-+S↓,
故答案为:加少量稀硫酸防止Fe2+水解,加少量铁粉(或铁钉)防止Fe2+氧化;H2S+Cl2=2 H++2Cl-+S↓;
(4)单质的熔点与晶体类型有关,原子晶体熔点最高,其次是原子晶体,最小的是分子晶体,分子晶体中常温下为气态的其熔点最小,属于熔点最小的是氯气,最高的是Si,硅形成的氧化物是二氧化硅,
故答案为:Cl2;SiO2.
点评:本题考查了元素周期表和元素周期律的应用,涉及离子反应方程式的书写、氧化性强弱的判断、电子式的书写等知识点,根据元素周期律结合物质之间的反应来分析解答,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
(7分)元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
|
A |
|
|
|||||||||||||||
|
|
|
|
|
D |
E |
|
|
|
|||||||||
|
G |
|
|
Q |
|
M |
R |
|
||||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
。
(3)M、D两种元素形成的化合物含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;
A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式) 。
A与D形成分子的空间结构可能是(填序号) 。(2分)