题目内容
1.碳及其化合物有广泛应用(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为CO-2e-+H2O=CO2+2H+
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.
①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{1{0}^{-12}}{a-1{0}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)?CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0mol H2O和1.0mol CO (g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)

分析 (1)在电解池中,阳极上是阴离子发生失电子的氧化反应;电解氧化铝生成铝和氧气,阳极发生氧化反应生成氧气,生成的氧气在高温下氧化石墨电极;
(2)酸性介质中,CO被氧化生成二氧化碳;
(3)n(KOH)=0.075L×4mol•L-1=0.3mol,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,因为二者按3:2恰好反应,据此书写反应的离子方程式;
②因为碳酸根水解程度大于碳酸氢根,并且水解后都成碱性,据此判断离子浓度大小;
③因为amol•L-1KHCO3溶液的pH=8,所以pH=10-6mol/L,HCO3-+H2O?H2CO3+OH-,c(OH-)=c(H2CO3)=10-6mol/L,水解程度小,消耗HCO3-可忽省不计,所以根据K=$\frac{C({H}_{2}C{O}_{3})C(O{H}^{-})}{C(HC{{O}_{3}}^{-})}$计算;
(4)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根据盖斯定律知,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);
(5)①从数据看,I和II达到相同状态,说明平衡没有移动,若该可逆反应是等气体分子数反应,则增大压强,平衡不移动,或者加入催化剂也能加快反应速率,平衡不移动;等气体分子数反应,可以用物质的量代替浓度计算平衡常数,达到平衡时,各物质的物质的量都等于0.5mol,根据K=$\frac{C(C{O}_{2})C({H}_{2})}{C(CO)C({H}_{2}O)}$计算;
②A、开始投入二氧化碳和氢气,从逆方向进行反应,反应吸热,开始温度下降,当温度不变时达到平衡状态;
B、开始投入二氧化碳和氢气,从逆方向进行反应,氢气体积分数由最大逐渐减小;
C、反应热只与化学计量数有关,与反应限度无关;
D、因为总质量不变,总物质的量也不变,根据混合气体平均相对分子质量=$\frac{m(总)}{n(总)}$判断.
解答 解:(1)电解氧化铝得到铝和氧气,阳极上氧离子失去电子发生氧化反应,电极反应式:2O2--4e-=O2↑;生成的氧气在高温下氧化石墨电极,发生的反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO),
故答案为:2O2--4e-=O2↑;C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO);
(2)在酸性介质中CO氧化生成CO2,负极反应式为CO-2e-+H2O=CO2+2H+,
故答案为:CO-2e-+H2O=CO2+2H+;
(3)n(KOH)=0.075L×4mol•L-1=0.3mol,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,因为二者恰好反应,则反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O,
故答案为:2CO2+3OH-=CO32-+HCO3-+H2O;
②因为碳酸根水解程度大于碳酸氢根,并且水解后都成碱性,所以离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③因为amol•L-1KHCO3溶液的pH=8,所以pH=10-6mol/L,HCO3-+H2O?H2CO3+OH-
c(OH-)=c(H2CO3)=10-6mol/L,水解程度小,消耗HCO3-可忽省不计,所以K=$\frac{C({H}_{2}C{O}_{3})C(O{H}^{-})}{C(HC{{O}_{3}}^{-})}$=$\frac{1{0}^{-12}}{a-1{0}^{-6}}$,
故答案为:$\frac{1{0}^{-12}}{a-1{0}^{-6}}$;
(4)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根据盖斯定律知,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)
△H=-571.6kJ•mol-1-566.0kJ•mol-1×$\frac{1}{2}$+90.8kJ•mol-1=-763.8kJ•mol-1,
故答案为:-763.8kJ•mol-1;
(5)①从数据看,I和II达到相同状态,说明平衡没有移动,若该可逆反应是等气体分子数反应,且反应物和产物都是气态,增大压强,平衡不移动,能缩短达到平衡的时间;加入催化剂也能加快反应速率,缩短达到平衡时间;
等气体分子数反应,可以用物质的量代替浓度计算平衡常数,达到平衡时,各物质的物质的量都等于0.5mol,所以K=$\frac{C(C{O}_{2})C({H}_{2})}{C(CO)C({H}_{2}O)}$=$\frac{0.5mol×0.5mol}{0.5mol×0.5mol}$=1,
故答案为:增大压强(或缩小体积)、加催化剂;1;
②A、开始投入二氧化碳和氢气,从逆方向进行反应,反应吸热,开始温度下降,当温度不变时达到平衡状态,故A正确;
B、开始投入二氧化碳和氢气,从逆方向进行反应,氢气体积分数由最大逐渐减小,故B错误;
C、反应热只与化学计量数有关,与反应限度无关,所以焓变一直不变,故C错误;
D、因为总质量不变,总物质的量也不变,所以混合气体平均相对分子质量=$\frac{m(总)}{n(总)}$始终不变,故D错误;
故选:A.
点评 本题考查化学平衡的标志、平衡常数的计算及化学平衡移动原理、盖斯定律的计算应用、离子浓度大小的比较、电解池反应原理及电极反应式的书写,知识点较多,综合性很强,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 该反应的反应热为△H=-571.6kJ/mol,是放热反应 | |
| B. | 该反应的△H与各物质的状态有关,与化学计量数也有关 | |
| C. | 该式的含义为:25℃、101kPa下,2mol氢气完全燃烧生成液态水时放出热量571.6kJ | |
| D. | 该反应为氢气燃烧的热化学方程式,由此可知氢气的燃烧热为571.6kJ/mol |
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| A | Z存在质量数为23,中字数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的小(填“大”或“小”);X 和Y的气态氢化物中,较稳定的是H2O(写化学式).
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:
 .
.(4)在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称:丙烷.氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:CH3COOH+HCO3-=CH3COO-+H2O+CO2↑.
(1)反应C(s)+H2O(g)?CO(g)+H2(g);△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量
B.升高温度
C.用CO吸收剂除去CO
D.加入催化剂.
(2)已知,C(s)+CO2(g)?2CO(g);△H=+172.5kJ•mol-1,则反应 CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ•mol-1.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为CH3OH-6e-+H2O═CO2+6H+.
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=0.36.
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
(1)已知:①Fe2O3+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1则a=-28.5kJ•mol-1.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L的恒容密闭容器甲和乙中,分别按照如表所示数据加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是AB(填字母)
a.容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙两容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3的量可以提高CO的转化率
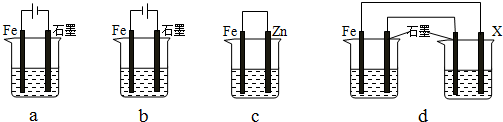
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里盛有等浓度、等体积的NaCl溶液.
①在a~c装置中,能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).
 .
.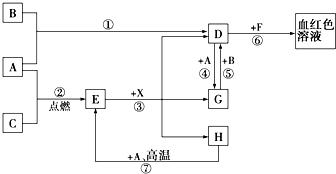 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去). 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题: