题目内容
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
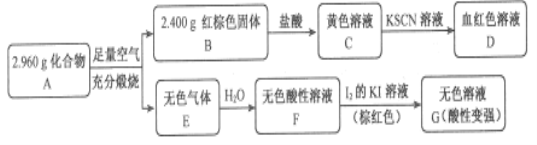
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),写出该反应的离子方程式_________
【答案】反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气 Al2O3 +2OH =2AlO2 +H2O S、Fe; Fe3S4 Fe3S4+6H+ =3H2S↑+3Fe2+ +S
【解析】
Ⅰ.(1)分解反应是吸热反应且生成的氧化镁、氧化铝的熔点高;
(2)产物中MgO只能溶于酸,而Al2O3 是两性氧化物,可选择NaOH溶液溶解除去;
Ⅱ.C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)=![]() =0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=
=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=![]() =0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4,以此解答该题。
=0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4,以此解答该题。
Ⅰ.(1)分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会隔绝空气阻止燃烧,且水蒸气稀释空气,故该化合物可作阻燃剂;
(2)产物中MgO只能溶于酸,而Al2O3 是两性氧化物,可选择NaOH溶液溶解除去,发生反应的离子方程式为Al2O3 +2OH =2AlO2 +H2O;
Ⅱ.C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)=![]() =0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=
=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=![]() =0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4;
=0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4;
(1)由以上分析可知,A组成元素为Fe、S,化学式为Fe3S4;
(2)化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL-1),淡黄色不溶物为S,气体的相对分子质量为1.518×22.4L=34,为H2S气体,则反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______区元素。
(2)③和⑧形成的一种常见溶剂,其分子立体空间构型为________。
(3)元素①和⑥形成的最简单分子X属于________分子(填“极性”或“非极性”)
(4)元素⑥的第一电离能________元素⑦的第一电离能;元素②的电负性________元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是________。
(6)元素⑧和④形成的化合物的电子式为________。
(7)某些不同族元素的性质也有一定的相似性,如表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:____________________。