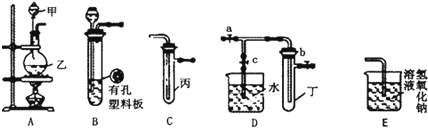
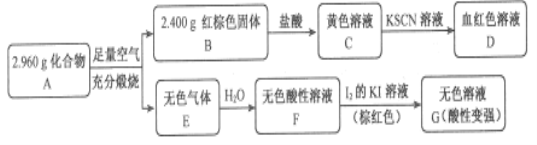
题目内容
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其周期数相同;B的价电子排布式为nsnnpn+2;短周期元素C和D为同周期不相邻的元素,C是同周期元素中离子半径最小的元素,D元素最外层有两个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料。回答下列问题:
(1)D元素在周期表中的位置为__________________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素名称)。
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是______(填化学式)。
(3)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是______(填标号)。
A.中心原子的价层电子对数目相等B.都是非极性分子C.中心原子的孤电子对数目相等D.都含有极性键E.都能与Na2O反应F.固态时晶体类型不同
(4)D在空气中燃烧的产物分子构型为______。固体DB3中存在如图(b)所示的三聚分子,该分子中D原子的杂化轨道类型为________。

【答案】第三周期ⅥA族 2 O H2SO4 DE V形 sp3
【解析】
A、B、C、D、E为原子序数依次增大的五种前四周期元素。由A的核外电子总数与其周期数相同可知,A为H元素;由B的价电子排布式为nsnnpn+2可知,B的价电子数为6,则B为O元素;短周期元素C和D为同周期不相邻的元素,由C是同周期元素中离子半径最小的元素可知,C为Al元素;由D元素最外层有两个未成对电子可知,D为S元素;由E位于元素周期表的第四周期第IVB族可知,E为Ti元素。
(1)D为S元素,位于元素周期表第三周期ⅥA族;E为Ti元素,基态原子的价电子排布式为3d24s2,有2个未成对电子;元素的非金属性越强,电负性越大,五种元素中,O元素非金属最强,则O元素的电负性最大,故答案为:第三周期ⅥA族;2;O;
(2)由H、O、S三种元素形成的常见三元化合物中具有强氧化性的是硫元素的最高价氧化物对应水化物硫酸,化学式为H2SO4,故答案为:H2SO4;
(3)A.水分子中氧原子的价层电子对数为4,三氧化硫分子中硫原子的价层电子对数为3,中心原子的价层电子对数目不相等,故错误;
B.水分子的空间构型为V形,结构不对称,为极性分子,故错误;
C.水分子中氧原子的孤对电子对数为2,三氧化硫分子中硫原子的孤对电子对数为0,中心原子的孤对电子对数目不相等,故错误;
D.水分子中含有的H、O键为极性键,三氧化硫分子中含有的S、O键为极性键,故正确;
E.水与氧化钠反应生成氢氧化钠,三氧化硫与氧化钠反应生成硫酸钠,水和三氧化硫都能与氧化钠反应,故正确;
F.固态时,水和三氧化硫都是分子晶体,分子晶体类型相同,故错误;
DE正确,故答案为:DE;
(4)D为S元素,硫在空气中燃烧生成二氧化硫,二氧化硫分子中价层电子对数为3,孤对电子对数为1,则空间构型为V形;由图可知,三聚三氧化硫分子中每个硫原子连接4个氧原子,形成四面体结构,则硫原子的杂化方式为sp3杂化,故答案为:V形,sp3。