题目内容
12.A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数之比为2:3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红.请回答下列问题:(1)Z的原子结构示意图为
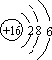 ;化合物B2A4的电子式为
;化合物B2A4的电子式为 .
.(2)化合物Y2X2中含有的化学键类型有AC(填序号).
A.离子键 B.极性共价键C.非极性键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是H2O(填化学式),其主要原因是H2O中存在氢键.
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:H2O2+H2S═2H2O+S↓.
(5)将Z与X形成的气态化合物ZX2通入Ba(NO3)2溶液中,有白色沉淀和一氧化氮气体生成,发生反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO+4H+,由此可得出一氧化氮与ZX2的还原性大小关系为NO<SO2.
(6)将Y2X2投入到Y2Z的水溶液中可生成Z的单质,发生反应的离子方程式为:Na2O2+S2-+2H2O=S+2Na++4OH-,请标出此反应中电子转移的方向和数目
 .
.(7)由BA4、X2、YXA溶液可以组成原电池,则组成该原电池的负极反应式为:CH4-8e-+10OH-=CO32-+7H2O.原电池工作一段时间后,整个溶液的pH将减小(填“增大”、“不变”或“减小”).
分析 A与B和A与X均可形成10个电子化合物,则A应为H元素,A与Y同主族,则Y为Na元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则X为O元素,Y2X2为Na2O2,X与Z同主族,则Z为S元素,B与Z的最外层电子数之比为2:3,则B元素的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增的短周期元素,B应为C元素,根据元素所在周期表中的位置,结合对应的化合物的结构和性质解答该题.
解答 解:A与B和A与X均可形成10个电子化合物,则A应为H元素,A与Y同主族,则Y为Na元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则X为O元素,Y2X2为Na2O2,X与Z同主族,则Z为S元素,B与Z的最外层电子数之比为2:3,则B元素的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增的短周期元素,B应为C元素,
(1)Z为S元素,核电核数为16,原子核外有3个电子层,最外层电子数为6,则原子结构示意图为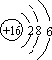 ,
,
化合物B2A4为C2H4,为共价化合物,电子式为 ,
,
故答案为: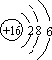 ;
; ;
;
(2)Y2X2为Na2O2,为离子化合物,化合物中含有过氧键,氧原子之间为非极性共价键,故答案为:AC;
(3)O原子半径较小,非金属性较强,H2O存在氢键,沸点在同主族元素中形成的氢化物最高,故答案为:H2O;H2O中存在氢键;
(4)A与X和A与Z均能形成18个电子的化合物,这两种化合物分别为H2O2和H2S,H2O2具有氧化性,H2S具有还原性,二者发生氧化还原反应生成H2O和S,
反应的方程式为H2O2+H2S═2H2O+S↓,故答案为:H2O2+H2S═2H2O+S↓;
(5)将Z与X形成的气态化合物SO2通入Ba(NO3)2溶液中,有白色沉淀(硫酸钡)和一氧化氮气体生成,发生反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO+4H+,该反应中S元素的化合价升高,由还原剂的还原性大于还原产物的还原性可知,还原性为NO<SO2,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO+4H+;NO<SO2;
(6)Y2X2投入到Y2Z的水溶液中可生成Z的单质,离子反应为Na2O2+S2-+2H2O=S+2Na++4OH-,该反应中S失去电子,过氧化钠中O得到电子,该反应转移2e-,则电子转移的方向和数目为 ,故答案为:Na2O2+S2-+2H2O=S+2Na++4OH-;
,故答案为:Na2O2+S2-+2H2O=S+2Na++4OH-; ;
;
(7)由BA4、X2、YXA溶液可以组成甲烷燃料电池,甲烷为负极,负极反应为CH4-8e-+10OH-=CO32-+7H2O,总反应为CH4+2O2+2OH-=CO32-+3H2O,消耗碱,则原电池工作一段时间后,整个溶液的pH将减小,故答案为:CH4-8e-+10OH-=CO32-+7H2O;减小.
点评 本题考查元素位置结构性质的关系及应用,为高频考点,侧重于物质的结构和性质及元素化合物知识、化学反应原理的综合考查,学习中注重相关基础知识的积累,试题培养了学生的分析、理解能力及灵活应用基础知识的能力,题目难度中等.

| A. | HF、HCI、HBr、HI的热稳定性依次减弱 | |
| B. | NaF、NaCl、NaBr、NaI的熔点依次减低 | |
| C. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
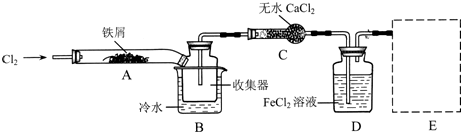
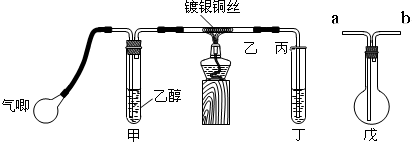
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是在沉积的FeCl3固体下方加热
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤
(4)装置B中冷水浴的作用为冷却,使FeCl3沉积,便于收集产品,装置C的名称为干燥管;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:酸性KMnO4溶液.
(5)在虚线框中画出尾气吸收装置E并注明试剂.
(6)用含有Al203、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:金属离子的起始浓度为0.1mol•L-1
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
( )
| A. | AlCl3 和NaOH | B. | H2SO4和BaCl2 | C. | NaHCO3和HCl | D. | NaCl和AgNO3 |
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 相对分子质量 |
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液不变浑浊.先通入CO2再通入氨气,溶液变浑浊 | CaCl2溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NO | B. | NO2 | C. | CO | D. | SO2 |