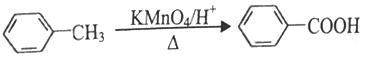题目内容
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
请回答下列问题:
(1)Ti的基态原子价电子排布式为______。
(2)纳米TiO2常用作下述反应的催化剂。
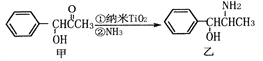
化合物甲的分子中采取sp2方式杂化的碳原子有_____________个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为___________________。
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是____________,1 mol该配合物中含有的![]() 键数目是____________。
键数目是____________。
(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种 离子晶体的晶格能数据如下:
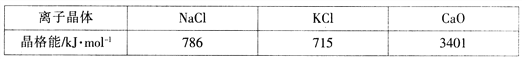
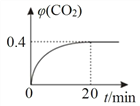
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为______________________。
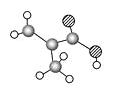
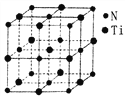
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有_____个:Ti原子的配位数为______;此配位原子构成的空间构型为_____;该晶胞中N、Ti原子之间的最近距离为a nm。则该氮化钛晶体的密度为______g·cm-3、NA为阿伏加德罗常数的值,只列计算式)。
【答案】 3d24s2 7 O>N>C 配位键、极性共价键 18NA TiN>MgO>CaO>KCl 12 6 正八面体 ![]() 。
。
【解析】(1)本题考查价电子和电子排布式,Ti属于过渡元素,价电子包括最外层电子和次外层d能级上的电子,即价电子排布式为3d24s2;(2)本题考查杂化类型和电负性的规律,苯环上的碳原子为sp2杂化,连有羟基的碳原子和甲基上的碳原子有4个σ键,无孤电子对,其杂化类型是sp3杂化,羰基上的碳原子有3个σ键,无孤电子对,其杂化类型为sp2杂化,因此有机物甲有7个sp2杂化的碳原子,化合物乙中采用sp3杂化的是,羟基连接的碳原子、甲基上的碳原子、N、O,同周期从左向右电负性增强,即O>N>C;(3)本题考查化学键的类型,Cl-和H2O与Ti3+形成配位键,H2O中H和O之间形成(极性)共价键;配离子中Cl-与Ti3+形成1molσ键,配离子中有5mol水分子,1mol水分子有2molσ键,水分子共形成10molσ键,5mol水与Ti3+形成5molσ键,此配合物中还含有结晶水,因此1mol配合物中含有σ键的数目是18NA;(4)考查晶格能,离子晶体熔沸点与晶格能有关,晶格能与离子半径和所带电荷数有关,离子半径越小,所带电荷数越多,晶格能越大,晶体的熔沸点越高,TiN所带电荷数最多,晶格能最大,MgO和CaO中Mg2+的半径小于Ca2+,MgO的熔点大于CaO,NaCl所带电荷数最少,因此熔点由高到低的顺序是TiN>MgO>CaO>KCl;(5)考查晶胞的结构和计算,根据晶胞的结构,与N距离相等且最近的N原子有12个,上层4个,中间4个,下层4个;离子晶体的配位数为一个离子周围最近的异性离子的个数,即Ti的配位数为6;构成的空间构型为正八面体;N位于晶胞的顶点、面心,个数为8×1/8+6×1/2=4个,Ti位于棱上和体心,个数为12×1/4+1=4,化学式为TiN,晶胞的质量为4×62/NAg,晶胞的边长是N、Ti原子之间的最近距离的2倍,则晶胞的体积为(2a×10-7)cm3,则晶胞的密度为![]() g/cm3。
g/cm3。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案