题目内容
【题目】标准状况下,0.5molCl2的体积约为( )
A.22.4L/molB.22.4LC.11.2LD.5.6L
【答案】C
【解析】
标准状况下,气体的摩尔体积是22.4L/mol,0.5molCl2的体积约为0.5mol×22.4L/mol=11.2L,故选C。

【题目】从下列实验事实所得出的相应结论正确的是
选项 | 实验事实 | 结论 |
A | Na2S2O3溶液与稀硫酸反应,其它条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其它条件不变时,增大反应物浓度,化学反应速率加快 |
B | 在化学反应前后,催化剂的质量化学性质都没有发生变化 | 催化剂一定不参与化学反应 |
C | H+浓度相同的盐酸和酷酸分别与等质量的形状相同的锌反应 | 前者速率快 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D
【题目】(1)已知下表数据:
化学式 | 电离平衡常数(25℃) |
HCN | K=5.0×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7 ,K2=4.7×10-11 |
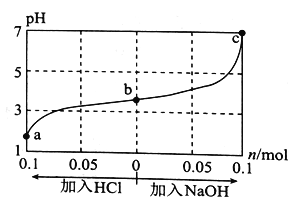
① 25℃时,等浓度的四种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液,pH由大到小的顺序为_______(填序号)。
② 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,则c(HCN)、c(H+)、c(OH-)、c(CN-)、c(Na+)浓度排序为_______,c(HCN)+c(CN-)_____(填“>”、“<”或“=”)0.1mol/L。
③ 相同条件下,取等体积等pH的a.HCN溶液 b. CH3COOH溶液 c.H2CO3溶液,各稀释100 倍,稀释后的溶液,其pH大小关系为_______(填序号)。
④ 25℃时,将体积为Va,pH = 13的某一元强碱与体积为Vb,pH=2的某二元强酸混合,若所得溶液的pH=11,则Va:Vb=________。
(2)温度为T℃时水的离子积常数为Kw,该温度下,将浓度为amol/L的H2SO4与bmol/L的一元碱AOH等体积混合。则可判断溶液呈中性的是_______(填序号)。
①混合溶液的pH=7 ②c(SO42-)=![]() c(A+)
c(A+)
③混合溶液中c(H+)c(OH-)=Kw ④ 混合溶液中c(OH-)=![]()