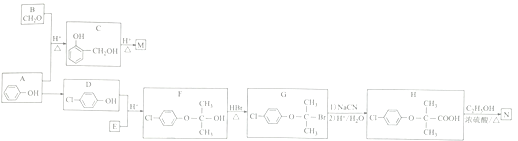
题目内容
【题目】(1)已知下表数据:
化学式 | 电离平衡常数(25℃) |
HCN | K=5.0×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7 ,K2=4.7×10-11 |
① 25℃时,等浓度的四种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液,pH由大到小的顺序为_______(填序号)。
② 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,则c(HCN)、c(H+)、c(OH-)、c(CN-)、c(Na+)浓度排序为_______,c(HCN)+c(CN-)_____(填“>”、“<”或“=”)0.1mol/L。
③ 相同条件下,取等体积等pH的a.HCN溶液 b. CH3COOH溶液 c.H2CO3溶液,各稀释100 倍,稀释后的溶液,其pH大小关系为_______(填序号)。
④ 25℃时,将体积为Va,pH = 13的某一元强碱与体积为Vb,pH=2的某二元强酸混合,若所得溶液的pH=11,则Va:Vb=________。
(2)温度为T℃时水的离子积常数为Kw,该温度下,将浓度为amol/L的H2SO4与bmol/L的一元碱AOH等体积混合。则可判断溶液呈中性的是_______(填序号)。
①混合溶液的pH=7 ②c(SO42-)=![]() c(A+)
c(A+)
③混合溶液中c(H+)c(OH-)=Kw ④ 混合溶液中c(OH-)=![]()
【答案】 b>a >d> c c(HCN) >c (Na+) >c (CN-) >c (OH- )>c( H+) 略 b> c> a 1:9 ②④
【解析】(1)①由表中电离平衡常数可知酸性大小:CH3COOH>H2CO3>HCN>HCO![]() (相应的酸根离子分别为CH3COO-、HCO
(相应的酸根离子分别为CH3COO-、HCO![]() 、CN-、CO
、CN-、CO![]() ),酸性越强,其盐溶液中酸根离子水解程度越大,故等浓度的四种溶液:a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液、d.NaHCO3溶液,pH由大到小的顺序为b>a>d>c。②反应后得到等浓度的HCN与NaCN的混合溶液,由溶液显碱性可推知CN-水解程度大于HCN的电离程度,故溶液中有关微粒的浓度大小为c(HCN)>c(Na+)>c(CN-)> c(OH-)>c(H+);等体积混合后有关粒子的浓度变为原来的一半,根据原子守恒可知c(HCN)+c(CN-)=0.1 mol·L-1。③酸越弱,稀释同样倍数,其pH改变越小,因此相同条件下,取等体积等pH的a.HCN溶液,b.CH3COOH溶液,c.H2CO3溶液,各稀释100倍,稀释后的溶液pH大小关系为b>c>a。④混合后溶液pH=11,说明混合后溶液中c(OH-)=10-3mol·L-1,故由题意得
),酸性越强,其盐溶液中酸根离子水解程度越大,故等浓度的四种溶液:a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液、d.NaHCO3溶液,pH由大到小的顺序为b>a>d>c。②反应后得到等浓度的HCN与NaCN的混合溶液,由溶液显碱性可推知CN-水解程度大于HCN的电离程度,故溶液中有关微粒的浓度大小为c(HCN)>c(Na+)>c(CN-)> c(OH-)>c(H+);等体积混合后有关粒子的浓度变为原来的一半,根据原子守恒可知c(HCN)+c(CN-)=0.1 mol·L-1。③酸越弱,稀释同样倍数,其pH改变越小,因此相同条件下,取等体积等pH的a.HCN溶液,b.CH3COOH溶液,c.H2CO3溶液,各稀释100倍,稀释后的溶液pH大小关系为b>c>a。④混合后溶液pH=11,说明混合后溶液中c(OH-)=10-3mol·L-1,故由题意得![]() =10-3,解得Va∶Vb=1∶9。(2)因温度不一定是25 ℃,故pH=7时溶液不一定呈中性;由c(SO
=10-3,解得Va∶Vb=1∶9。(2)因温度不一定是25 ℃,故pH=7时溶液不一定呈中性;由c(SO![]() )=
)=![]() c(A+)及电荷守恒可知溶液中c(H+)=c(OH-),则溶液一定呈中性;无论溶液呈酸性、中性还是碱性,混合溶液中总存在c(H+)·c(OH-)=Kw;混合溶液中c(OH-)=
c(A+)及电荷守恒可知溶液中c(H+)=c(OH-),则溶液一定呈中性;无论溶液呈酸性、中性还是碱性,混合溶液中总存在c(H+)·c(OH-)=Kw;混合溶液中c(OH-)=![]() mol·L-1,可说明混合溶液中c(H+)=c(OH-),则溶液一定呈中性。
mol·L-1,可说明混合溶液中c(H+)=c(OH-),则溶液一定呈中性。