题目内容
12.下列关于0.2mol/LNaHCO3溶液的说法正确的是( )| A. | 溶质电离方程式为NaHCO3═Na++H++CO32- | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
分析 A.碳酸氢根离子不可拆分;
B.加水稀释后,促进HCO3-水解,但Kw不变;
C.溶液遵循电荷守恒;
D.HCO3-水解为吸热反应,升高温度,促进水解.
解答 解:A.NaHCO3为强电解质,溶质的电离方程式为NaHCO3═Na++HCO3-,故A错误;
B.25℃时,加水稀释后,促进HCO3-水解,n(OH-)增大,c(OH-)减小,由Kw不变,可知c(H+)增大,则n(H+)增大,则n(H+)与n(OH-)的乘积变大,故B正确;
C.由电荷守恒可知,离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D.HCO3-水解为吸热反应,升高温度,促进水解,则c(HCO3-)减小,故D错误;
故选B.
点评 本题电离、水解及溶液中离子浓度关系的考查,选项B为解答的易错点,注意稀释促进水解时浓度与物质的量的变化不同,题目难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
2.已知2Fe+3Br2═2FeBr3、2Fe3++2I-═2Fe2++I2、4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+现将Fe(NO3)2溶液分别滴入到以下溶液中①H2SO4 ②HNO3 ③溴水 ④碘水,其中能使Fe2+转变为Fe3+的是( )
| A. | ①②③④ | B. | 只有②③ | C. | ①②③ | D. | ②③④ |
3.下列说法正确的是( )
| A. | 在化学反应中,原子重新组合时伴随着能量的变化 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
17.绿色化学最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.以下反应最符合这一要求的是( )
| A. | 铜和浓硝酸反应制硝酸铜 | |
| B. | 用铜作催化剂将乙醇氧化为乙醛 | |
| C. | 乙烯聚合为聚乙烯 | |
| D. | 光照条件下甲烷与氯气反应制一氯甲烷 |
1.将标况下的2.24LCO2通入150mL 1mol•L-1NaOH溶液中,溶液中离子浓度由小到大的顺序为 ( )
| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | B. | c(Na+)>c(HCO3-)=c(CO32-)>c(OH-)>c(H+). | ||
| C. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
1.BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R.反应过程中新形成的化学键中无( )


| A. | 离子键 | B. | 配位键 | C. | 金属键 | D. | 氢键 |
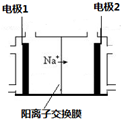 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,其中如图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是阴极,并写出电极1的电极反应式2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,其中如图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是阴极,并写出电极1的电极反应式2Cl--2e-=Cl2↑.