题目内容
16.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③3.4g NH3,这三种气体中氢原子个数从多到少的顺序表达正确的是( )| A. | ①②③ | B. | ②③① | C. | ②①③ | D. | ①③② |
分析 结合标准状况下,气体的Vm=22.4L/mol,结合n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$以及物质的分子构成解答.
解答 解:在标准状况下①6.72L CH4,n(CH4)=$\frac{6.72L}{22.4L/mol}$=0.3mol,
②3.01×1023个HCl分子,n(HCl)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,
③3.4g NH3,n(NH3)=$\frac{3.4g}{17g/mol}$=0.2mol,
物质的量越多,原子个数越多,0.3molCH4含有1.2molH,0.5molHCl含有0.5molH,0.2molNH3含有0.6molH,则氢原子个数大小为①>③>②,
故选D.
点评 本题综合考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意把握物质的构成以及相关计算公式的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列各组物质中,滴加KSCN溶液后立即变成红色的是( )
| A. | 稀HNO3和Fe(NO3)2 | B. | 铁和ZnSO4 | C. | Zn和FeCl2 | D. | Fe和HCl |
7. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
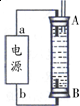
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是
ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是
ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
1.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| B. | 32g O2中含有的分子数为NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| D. | 1 L 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |
 ;
;