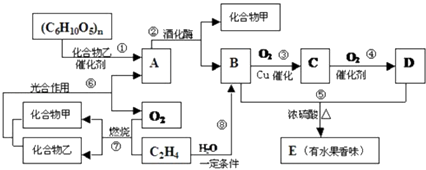
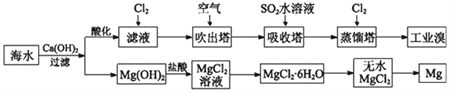
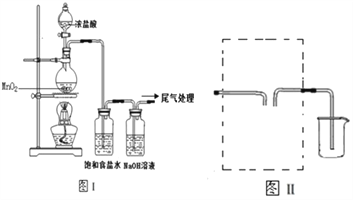
题目内容
【题目】将标准状况下1.68 L CO2通入含有2 g NaOH的水溶液中,完全反应并得到2 L碱性溶液.则对于该溶液表述正确的是
A. 2c(Na+)=3[c(HCO3-) +c(CO32-)+c(H2CO3)]
B. c(Na+)+c(H+ )=c(HCO3-)+2c(CO32-)+c(OH-)
C. HCO3-的电离程度大于HCO3-的水解程度
D. 存在的平衡体系只有:HCO3- +H2O![]() H2CO3+OH-,HCO3-
H2CO3+OH-,HCO3-![]() H++CO32-
H++CO32-
【答案】B
【解析】将标准状况下1.68 L CO2的物质的量是0.075mol,2 g NaOH的物质的量是0.05mol,完全反应生成0.0mol的碳酸氢钠。根据物料守恒, c(Na+)=c(HCO3-) +c(CO32-)+c(H2CO3),故A错误;根据电荷守恒,c(Na+)+c(H+ )=c(HCO3-)+2c(CO32-)+c(OH-),故B正确;HCO3-的水解程度大于HCO3-的电离程度,故C错误;存在的平衡体系有:HCO3- +H2O![]() H2CO3+OH-,HCO3-
H2CO3+OH-,HCO3-![]() H++CO32-,H2O
H++CO32-,H2O![]() H++OH-,故D错误。
H++OH-,故D错误。

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目