题目内容
【题目】利用海水可以提取溴和镁,提取过程如下。
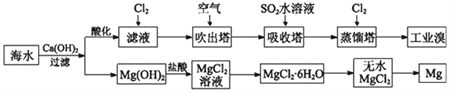
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是_____________________,吸收塔中发生反应的离子方程式是___________________________________。用平衡移动原理解释通空气的主要目的是:____________________________。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是______、____、过滤、洗涤、干燥。
【答案】 对溴元素进行富集 SO2+Br2+2H2O=4H++2Br-+SO42— 通入空气将溴蒸气带出,使Br2(aq)![]() Br2(g)平衡向右移动 加热浓缩 冷却结晶
Br2(g)平衡向右移动 加热浓缩 冷却结晶
【解析】试题分析:
(1)第一次Br-→Br2转化是为了把海水中的溴离子氧化为溴并用热空气吹出来、用二氧化硫水溶液吸收,这样就把大量海水中少量的溴离子富集到少量的溶液中;第二次Br-→Br2转化是为了把溴离子再氧化为溴。所以提取溴的过程中,经过两次Br-→Br2转化的目的是对溴元素进行富集,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42—。溴易挥发,溶液中的溴分子与溶液表面的气体中的溴分子存在一个平衡。所以通空气的主要目的用平衡移动原理可以这样解释:通入空气可以把溴分子带走,从而减小气体中溴分子的浓度,使Br2(aq)![]() Br2(g)平衡向右移动。
Br2(g)平衡向右移动。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是加热浓缩、冷却结晶、过滤、洗涤、干燥。

【题目】化学反应过程中,不仅有物质的变化,同时还伴随有能量的变化。
(1)已知几种化学键的键能如表所示:
化学键 | Cl—Cl | F—F | Cl—F |
键能/ kJ·mol—1 | 242 | 159 | 172 |
则反应Cl2(g)+ 3F2(g)![]() 2ClF3(g) 的△H=_____________ kJ·mol—1 。
2ClF3(g) 的△H=_____________ kJ·mol—1 。
(2)如图是乙烷、二甲醚燃烧过程中的能量变化图。

请回答下列问题:
①乙烷的燃烧热ΔH=____kJ·mol-1。
②等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物时放出的热量__(填“多”或“少”)。
③根据题图写出二甲醚完全燃烧时的热化学方程式_____________。
(3)实验室用50mL 0.50mol·L﹣1HCl与50mL 0.55mol·L﹣1NaOH溶液测定中和热。
①若改用60mL HCl进行实验,与原实验相比,所放出的热量____(填“相等”或“不相等”,忽略实验本身误差,下同),所求中和热_____(填“相等”或“不相等”,)。
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求中和热数值会___(填“偏大”“偏小”或“无影响”)。