题目内容
7.下列叙述正确的是( )| A. | 所有的非金属元素都分布在p区 | |
| B. | 在CaO和SiO2晶体中都不存在单个小分子 | |
| C. | 单质中一定含有非极性键 | |
| D. | C2H6是碳链为直线型的非极性分子,可推测C3H4也是碳链为直线型的非极性分子 |
分析 A.氢元素处于s区;
B.CaO和SiO2晶体分别为离子晶体和原子晶体;
C.稀有气体单质中不存在任何化学键;
D.乙烷中两个甲基对称,是非极性分子,而C3H4正负电荷中心不对称,是极性分子.
解答 解:A.除氢元素处于s区,其它非金属元素都处于p区,故A错误;
B.CaO和SiO2晶体分别为离子晶体和原子晶体,均不存在分子,故B正确;
C.稀有气体单质中不存在任何化学键,故C错误;
D.乙烷中两个甲基对称,是非极性分子,而C3H4正负电荷中心不对称,是极性分子,故D错误;
故选B.
点评 本题考查化学键,为高频考点,把握物质中的化学键及化学键形成、化学键判断的一般规律为解答的关键,注意晶体类型与构成微粒,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
17.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式沉淀时的pH如表:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外,还需要的主要仪器有漏斗、蒸发皿.
(2)“碱浸”过程中发生反应的离子方程式有Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).

部分阳离子以氢氧化物形式沉淀时的pH如表:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式有Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
2.25℃时,[NH4+]浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液,若其浓度分别为a、b、c(单位:mol/L),则下列判断正确的是( )
| A. | a=b=c | B. | c>a>b | C. | b>a>c | D. | a>c>b |
19.在无色透明的未知溶液中加入BaCl2溶液生成不溶于稀硝酸的白色沉淀,则未知溶液中可能大量存在( )
| A. | Ag+ | B. | SO42- | C. | CO32- | D. | OH- |
16.下列离子方程式的书写正确的是( )
| A. | 铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O | |
| C. | 氯化铝溶液与足量氨水反应:Al3++4OH-=AlO2-+2H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |

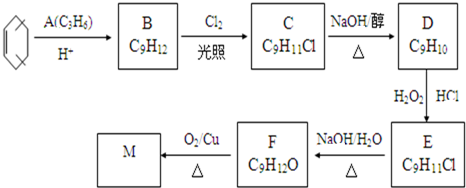
 ;
; ;
;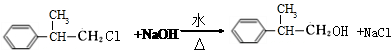 .
.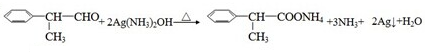 .
.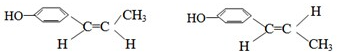 .
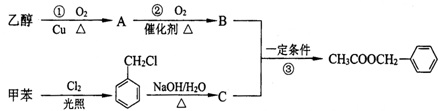
.
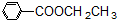 、
、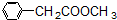 、
、
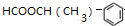 和
和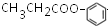 .
.