题目内容
下列叙述正确的是
①7Li+中含有的中子数与电子数之比为2︰1
② 在C2H6分子中极性共价键与非极性共价键数之比为3︰1
③ 常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1
④5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1
①7Li+中含有的中子数与电子数之比为2︰1
② 在C2H6分子中极性共价键与非极性共价键数之比为3︰1
③ 常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1
④5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1
| A.①② | B.②③ | C.①③ | D.③④ |
C
试题分析:①7Li+中含有的中子数是4,电子数是2,之比为2:1,正确;②C2H6分子中极性共价键数是6,非极性共价键数是1,之比为6:1,错误;③甲烷的分子组成与条件、体积无关,氢、碳原子数之比始终是为4︰1,正确;④铁与足量的氯气反应生成氯化铁,所以5.6g铁失去电子的物质的量为0.3mol,参与反应的铁的物质的量为0.1mol,之比为3:1,错误,答案选C。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
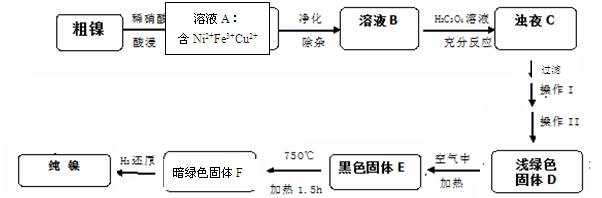
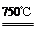 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑ Si3N4+6CO。下列叙述正确的是
Si3N4+6CO。下列叙述正确的是 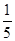 ,则样品中铁、铝的物质的量之比为( )。
,则样品中铁、铝的物质的量之比为( )。