题目内容
【题目】某兴趣小组采用以下装置进行铁粉和水蒸气的实验,并对反应后的产物进行探究.
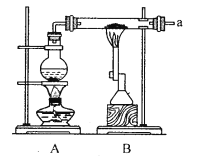
(1)铁粉与水蒸气反应的化学方程式为______;烧瓶中加入沸石的目的是_______
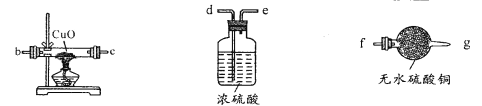
(2)用下图装置检验生成气体,连接顺序为(用字母表示)a![]() _______。
_______。
(3)证明反应后的固体中存在二价铁(限选试剂:1mol/LH2SO4、2mol/LHNO3、3%H2O2、0.01mol/LKMnO4、NaOH稀溶液、20%KSCN溶液、Fe2(SO4)3溶液)
步骤一:取反应后固体浸入Fe2(SO4)3溶液,充分反应后过滤并洗涤固体,其目的是_______;
步骤二:取过滤后所得固体加入过量_______,过滤;
步骤三:___________。
(4)取B中反应后的固体加足量稀硫酸溶解,再先后滴加KSCN溶液和氯水,溶液红色加深。请从平衡角度解释红色变深的原因_________。
【答案】 3Fe+4H2O(g)![]() Fe3O4+4H2 防止暴沸 d-e-b-c-f或d-e-c-b-f 利用Fe2(SO4)3溶液来氧化除去Fe单质,避免对后续实验造成干扰 1mol/LH2SO4 向滤液中加入适量0.01mol/L的KMnO4溶液,若溶液紫红色褪去,说明原产物中含有二价铁 Cl2将溶液中的Fe2+氧化成Fe3+,使得Fe3++3SCN-
Fe3O4+4H2 防止暴沸 d-e-b-c-f或d-e-c-b-f 利用Fe2(SO4)3溶液来氧化除去Fe单质,避免对后续实验造成干扰 1mol/LH2SO4 向滤液中加入适量0.01mol/L的KMnO4溶液,若溶液紫红色褪去,说明原产物中含有二价铁 Cl2将溶液中的Fe2+氧化成Fe3+,使得Fe3++3SCN-![]() Fe(SCN)3平衡正向移动,红色加深
Fe(SCN)3平衡正向移动,红色加深
【解析】(1)铁粉与水蒸气反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;反应需要加热,因此烧瓶中加入沸石的目的是防止暴沸;(2)由于反应生成的氢气中含有水蒸气,还原氧化铜之前需要干燥,最后用无水硫酸铜检验水的存在,则连接顺序为a-d-e-b-c-f或a-d-e-c-b-f。(3)步骤一:由于反应中铁过量,则取反应后固体浸入Fe2(SO4)3溶液充分反应后过滤并洗涤固体的目的是利用Fe2(SO4)3溶液来氧化除去Fe单质,避免对后续实验造成干扰;步骤二:溶解四氧化三铁时不能选择氧化性酸,则取过滤后所得固体加入过量1mol/LH2SO4,过滤;亚铁离子检验还原性,可以用酸性高锰酸钾溶液检验亚铁离子,则步骤三:向滤液中加入适量0.01mol/L的KMnO4溶液,若溶液紫红色褪去,说明原产物中含有二价铁;(4)由于Cl2将溶液中的Fe2+氧化成Fe3+,铁离子浓度增大,使得平衡Fe3++3SCN-
Fe3O4+4H2;反应需要加热,因此烧瓶中加入沸石的目的是防止暴沸;(2)由于反应生成的氢气中含有水蒸气,还原氧化铜之前需要干燥,最后用无水硫酸铜检验水的存在,则连接顺序为a-d-e-b-c-f或a-d-e-c-b-f。(3)步骤一:由于反应中铁过量,则取反应后固体浸入Fe2(SO4)3溶液充分反应后过滤并洗涤固体的目的是利用Fe2(SO4)3溶液来氧化除去Fe单质,避免对后续实验造成干扰;步骤二:溶解四氧化三铁时不能选择氧化性酸,则取过滤后所得固体加入过量1mol/LH2SO4,过滤;亚铁离子检验还原性,可以用酸性高锰酸钾溶液检验亚铁离子,则步骤三:向滤液中加入适量0.01mol/L的KMnO4溶液,若溶液紫红色褪去,说明原产物中含有二价铁;(4)由于Cl2将溶液中的Fe2+氧化成Fe3+,铁离子浓度增大,使得平衡Fe3++3SCN-![]() Fe(SCN)3正向移动,因此红色加深。
Fe(SCN)3正向移动,因此红色加深。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________。
(2)根据下表Cr原子的能级电离能(I:k]/mo1)数据,解释原子逐级电离能增大的原因:_______。
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____,N的杂化方式为________,写出NH3的一种等电子体___________。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________。
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.NaB.PoC.MgD.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏加德罗常数用NA表示,则Cr的原子半径是__pm.(写出表达式即可)
