题目内容
【题目】将一定质量的Mg—Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。回答下列问题。
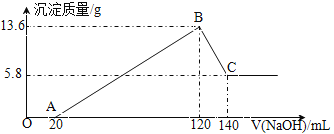
(1)原Mg-Al合金的质量是_________,合金中Mg与Al的物质的量之比是________;
(2)所加NaOH溶液的物质的量浓度是________________;
(3)原HCl溶液的物质的量浓度是_____________________。
(4)向含有0.1molNH4Al(SO4)2的溶液中逐滴加入5mol·L-1NaOH溶液,开始发现熔液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体(NH3)逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。________
【答案】 5.1 g 1∶1 6 mol·L1 5 mol·L1 
【解析】分析图象可知,Mg—Al合金与HCl反应时,盐酸过量,图象中各线段对应的化学反应如下:OA段:①H++OH-=H2O,AB段:②Mg2++2OH-=Mg(OH)2↓和③Al3++3OH-=Al(OH)3↓,BC段:④Al(OH)3+OH-=AlO2-+2H2O。据此解析如下:
(1) B点对应的沉淀为Al(OH)3和Mg (OH)2,其总质量为13.6g,C点对应的沉淀为Mg (OH)2,其质量为5.8g,所以n[Mg (OH)2]= n(Mg)=0.1mol,即金属镁的质量为2.4g;则
n(Al)= n[Al(OH)3]= ![]() =0.1mol,则金属铝的质量为2.7g,所以合金中Mg与Al的物质的量之比为1∶1,合金的总质量为5.1g。
=0.1mol,则金属铝的质量为2.7g,所以合金中Mg与Al的物质的量之比为1∶1,合金的总质量为5.1g。
(2) 由(1)的分析可知 n[Al(OH)3] =0.1mol,则反应④中溶解Al(OH)3沉淀需要n(NaOH)= 0.1mol,BC段加入氢氧化钠溶液的体积为20mL,所以c(NaOH)= ![]() = 5mol/L。
= 5mol/L。
(3)当加入NaOH溶液的体积为120mL时,即B点的溶液中溶质只有NaCl,根据其组成比即n(Na+)=n(Cl-),可得n(NaOH)=n(HCl)=0.12L×5mol/L=0.60mol,所以c(HCl)= ![]() =
=
6mol/L。
(4)据题意,加入NaOH溶液时,先与Al3+反应,再与NH4+反应,最后Al(OH)3溶解,反应的离子方程式依次为①Al3++3OH-=Al(OH)3↓,②NH4++OH-=NH3+H2O,③Al(OH)3+OH-=AlO2-+2H2O,由NH4Al(SO4)2的物质的量为0.1mol和c(NaOH)= 5mol/L,求出反应①中生成n[Al(OH)3] =0.1mol,消耗V(NaOH)=60mL,反应②消耗V(NaOH)=20mL,反应③消耗V(NaOH)=20mL,由此可画出图象如答案所示。