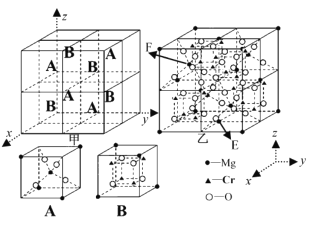
题目内容
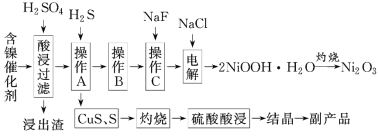
【题目】为回收利用含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
已知:①常温下有关氢氧化物开始沉淀和沉淀完全时的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式:__。
(2)浸出渣主要成分为CaSO4·2H2O和__两种物质。
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤。请对该实验操作进行评价并说明理由:__(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)流程中的“副产品”为__(填化学式)。在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L0.6mol·L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况下),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗__molH2SO4。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中![]() =__。
=__。
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-。生产1molClO-,消耗OH-__mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为__。
【答案】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O BaSO4 方案错误,在调节pH前,应先向滤液中加入H2O2,使滤液中的Fe2+氧化为Fe3+ CuSO4·5H2O 0.1 1.0×10-3 2 ClO-+2Ni2++4OH-=2NiOOH·H2O↓+Cl-
【解析】
根据题给信息知含镍催化剂加入硫酸酸浸,NiO转化为硫酸镍,Fe2O3转化为硫酸铁,CaO转化为硫酸钙,CuO转化为硫酸铜,BaO转化为硫酸钡,硫酸钡为难溶物,硫酸钙为微溶物,过滤,浸出渣为CaSO4·2H2O和BaSO4两种物质;向滤液中通入H2S,发生的反应为H2S+Cu2+=2H++CuS↓、2Fe3++H2S=2Fe2++S↓+2H+,过滤得CuS、S,灼烧生成铜的氧化物和二氧化硫,加硫酸酸浸得硫酸铜溶液,结晶得CuSO4·5H2O;操作B为除去混合液中的铁元素,结合题给数据知应先用双氧水将Fe2+氧化为Fe3+,再调节pH使铁元素转化为氢氧化铁沉淀,过滤,然后向滤液中加入NaF溶液,使Ca2+转化为CaF2沉淀,过滤,向滤液中加入NaCl电解生成2NiOOH·H2O,灼烧得Ni2O3,据此作答。
(1)Fe2O3为碱性氧化物,与硫酸反应生成Fe2(SO4)3和H2O,化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)由分析可知,浸出渣主要成分为CaSO4·2H2O和BaSO4两种物质;
(3)操作A所得的滤液中铁元素以Fe2+形式存在,向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,铁元素沉淀不完全,故该实验方案错误,应在调节pH前,先向滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;
(4)流程中的“副产品”为CuSO4·5H2O,Cu、Cu2O、CuO与HNO3恰好完全反应时生成Cu(NO3)2、NO和H2O,硝酸的物质的量为1 L×0.6 mol·L-1=0.6 mol,NO的物质的量为0.1 mol,根据N原子守恒可知:n[Cu(NO3)2]=0.25 mol,混合物中所含的Cu元素共有0.25 mol;根据电子转移守恒得混合物中n(Cu2O)=0.05 mol,n(CuO)=0.25 mol-0.1 mol-0.05 mol×2=0.05 mol,混合物中,0.1 mol Cu不与稀H2SO4反应,0.05 mol Cu2O、0.05 mol CuO与稀H2SO4反应,根据Cu2O、CuO中氧原子与H2SO4电离的H+生成H2O,可得n(H2SO4)=0.05 mol+0.05 mol=0.1 mol;
(5)为了除去溶液中的Ca2+,控制溶液中F-浓度为3×10-3 mol·L-1,溶液中c(Ca2+)=![]() =
=![]() mol·L-1=3×10-6 mol·L-1,则溶液中
mol·L-1=3×10-6 mol·L-1,则溶液中![]() =1.0×10-3;
=1.0×10-3;
(6)①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为Cl-+2OH--2e-=ClO-+H2O,生产1 mol ClO-,消耗2 mol OH-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH·H2O↓+Cl-。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案