题目内容
【题目】某学习小组为探究传统的Al—空气—海水电池,设计了如图所示的实验装置。该电池工作时,下列说法正确的是( )
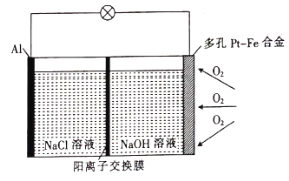
A.多孔Pt—Fe合金电极有利于吸附O2
B.负极的电极反应式为![]()
C.若反应中消耗5.4 g Al,则消耗3.36 L O2
D.当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
【答案】A
【解析】
A.多孔Pt—Fe合金表面积较大,与氧气的接触面积大,有利于吸附氧气,故A正确;
B.根据电极材料可知铝电极发生氧化反应为负极,但电解质溶液为中性,所以电极反应为Al-3eˉ=Al3+,故B错误;
C.未注明温度和压强无法计算氧气的体积,故C错误;
D.氧气参与电极反应时被还原成-2价,所以1mol氧气参加反应时有4mol电子转移,但电解质溶液的阳离子有Na+和Al3+,所以转移的阳离子不是4mol,故D错误;
综上所述答案为A。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】为回收利用含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
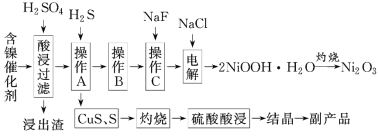
已知:①常温下有关氢氧化物开始沉淀和沉淀完全时的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式:__。
(2)浸出渣主要成分为CaSO4·2H2O和__两种物质。
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤。请对该实验操作进行评价并说明理由:__(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)流程中的“副产品”为__(填化学式)。在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L0.6mol·L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况下),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗__molH2SO4。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中![]() =__。
=__。
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-。生产1molClO-,消耗OH-__mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为__。
【题目】分别在三个容积均为2.0L的恒容密闭容器中发生反应:A(g)+B(g)D(g)。其中容器甲中反应进行至5min时达到平衡状态,相关实验数据如表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | 化学平衡常数 | ||
n(A) | n(B) | n(D) | n(D) | |||
甲 | 500 | 4.0 | 4.0 | 0 | 3.2 | K1 |
乙 | 500 | 4.0 | a | 0 | 2.0 | K2 |
丙 | 600 | 2.0 | 2.0 | 2.0 | 2.8 | K3 |
下列说法不正确的是
A.0~5min内,甲容器中A的平均反应速率v(A)=0.64mol·L-1·min-1
B.a=2.2
C.若容器甲中起始投料为2.0molA、2.0molB,反应达到平衡时,A的转化率小于80%
D.K1=K2>K3