题目内容
室温下,将20 ml 5.0×10-6 mol/L的盐酸和80 ml 1.0×10-6 mol/L的NaOH溶液混合,充分反应后将溶液稀释至1000 ml,试计算稀释后溶液的PH.
答案:
解析:
解析:
|
解:经判断酸过量,反应后未稀释时的浓度为: (5×20×10-6-1×80×10-6)/100=2×10-7 mol/L 稀释到1000 ml,稀释了10倍,浓度变为:2×10-8 mol/L,不可能把酸稀释为碱,此时氢离子主要由水电离,所以溶液的PH=7. |

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
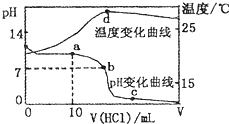 室温下,将1.00mol?L-1盐酸滴入20.00 mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.00mol?L-1盐酸滴入20.00 mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )A、a点溶液中离子浓度大小的关系:c(NH
| ||
B、b点溶液中离子浓度大小的关系:c(NH
| ||
C、c点溶液中离子浓度大小的关系:c(NH
| ||
| D、d点时溶液温度达到最高,之后温度略有下降,原因是NH3?H2O电离吸热 |
(9分)有A、B、C、D四种短周期元素在周期表中相对位置如右图:
|
A |
|
|
|
|
|
B |
C |
D |
(1)A与D形成的液态化合物是常见的重要有机溶剂,则A、B、C、D四种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_______>_________>___________>______(用化学式表示),B、C、D三种元素的第一电离能由大到小的顺序是:______________(用元素符号表示)(2)X、Y为C、D两种元素形成的单质。标准状况下,X的密度为3.17 g/L。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol/L Z水溶液pH=13。X、Y、Z有如图转化关系:
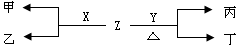
①写出X与Z反应的离子方程式:_____________________________
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的化学式_______,丁的水溶液pH>7的原因: ___________________________________(用离子方程式表示)
③将20 mL 0.5 mol/L丙溶液逐滴加入20 mL 0.2 mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式 _________。