题目内容
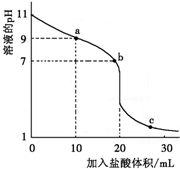
室温下,将0.100 0 mol·L-1盐酸滴入20.00 ml 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图。下列有关说法不正确的是

A.该一元碱溶液浓度为0.100 0 mol·L-1
B.a、b、c点的水溶液导电性依次增强
C.室温下,MOH的电离常数Kb=1×10-5
D.b点:c(M+)+c(MOH)=c(Clˉ)
【答案】
D
【解析】
试题分析:A、根据图象知,当盐酸体积为20mL时二者恰好反应生成盐,则二者的物质的量相等,二者的体积相等,则其浓度相等,所以一元碱溶液浓度为0.100 0 mol?L-1,故A正确;B、溶液的导电能力与离子浓度成正比,MOH是弱电解质,HCl、MCl是强电解质,完全电离,根据图象知,a、b、c点的水溶液中,溶液中自由移动离子浓度逐渐增大,所以其导电性依次增强,故B正确;C、根据图象知,0.1000mol/LMOH溶液中pH=11,则c(OHˉ)=0.001mol/L,常温下,MOH的电离常数Kb= =
= =1×10-5,故C正确;D、b点溶液呈中性,则c(H+)=c(OHˉ),根据电荷守恒得c(M+)+c(H+)=c(OHˉ)+c(Clˉ),所以得c(M+)=c(Clˉ),故D错误,答案选D。
=1×10-5,故C正确;D、b点溶液呈中性,则c(H+)=c(OHˉ),根据电荷守恒得c(M+)+c(H+)=c(OHˉ)+c(Clˉ),所以得c(M+)=c(Clˉ),故D错误,答案选D。
考点:考查酸碱混合溶液定性判断、pH计算以及溶液中离子浓度关系的有关判断

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
室温下,将0.1 mol下列物质分别加入蒸馏水中制成100 mL溶液,所得溶液中阴离子数目的大小顺序是①Na2O2 ②Na2O ③Na2CO3 ④Na2SO4
| A.①>②>③>④ | B.①>②>④>③ | C.①=②>③>④ | D.①=②>③=④ |
 室温下,将0.100 0mol?L-1盐酸滴入20.00mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.100 0mol?L-1盐酸滴入20.00mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )