题目内容
2.1-溴丙烷分别与NaOH的乙醇溶液和NaOH的水溶液共热的反应( )| A. | 产物相同 | B. | 都要断裂碳氢键 | C. | 产物不同 | D. | 反应类型相间 |
分析 卤代烃在氢氧化钠存在下水解生成醇和氯化氢;卤代烃在氢氧化钠的醇溶液中发生消去反应,是与卤素原子相邻的碳上的一个氢同时脱去,形成不饱和键.
解答 解:A.1-溴丙烷与NaOH的水溶液反应生成丙醇和溴化钠,与NaOH的乙醇溶液反应生成丙烯和溴化氢,故A错误;
B.1-溴丙烷与NaOH的水溶液反应生成丙醇和溴化钠,只断裂碳溴键,故B错误;
C.1-溴丙烷与NaOH的水溶液反应生成丙醇和溴化钠,与NaOH的乙醇溶液反应生成丙烯和溴化氢,产物不同,故C正确;
D.1-溴丙烷与NaOH的水溶液反应生成丙醇和溴化钠,与NaOH的乙醇溶液反应生成丙烯和溴化氢,前者为取代反应,后者为消去反应,故D错误.
故选C.
点评 本题考查有机物的结构和性质,注意Br原子的位置,溴代烃在氢氧化钠醇溶液中可发生消去反应,在氢氧化钠水溶液中可发生取代反应,注意把握有机物的结构,题目难度不大.

练习册系列答案
相关题目
12.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( ) 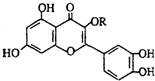

| A. | 可以和溴水反应 | |
| B. | 可用有机溶剂萃取 | |
| C. | 分子中的官能团有羟基、酯基、醚键、羰基、碳碳双键、苯环 | |
| D. | 1mol维生素P可以和4molNaOH反应 |
10.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是( )
| A. | KNO3是还原剂,其中N元素被氧化 | |
| B. | 生成物中的N2是氧化产物,K2O是还原产物 | |
| C. | 若有65 g NaN3参加反应,则被氧化N的物质的量为3.2mol | |
| D. | 每转移1 mole-,可生成标准状况下N2的体积为35.84L |
7.下列说法中正确的是( )
| A. | 两种盐溶液混合就一定能生成两种新盐 | |
| B. | 金属和酸都能发生置换反应生成氢气 | |
| C. | 金属与盐溶液反应一定得到金属和新盐 | |
| D. | 碱性氧化物加入水后不一定生成碱 |
19.某同学受硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2的启发,提出过量氯气与铁反应生成FeCl3、氯气与过量铁粉反应生成FeCl2的观点.为了验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质A,然后通过实验确定其成分.探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设1:该固体物质是FeCl2;
假设2:该固体物质是FeCl3;
假设3:该固体物质是FeCl3和FeCl2.
(2)设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如下表:(请在表格的横线处填空)
(3)已知 Fe(NO3)2溶液为浅绿色,往Fe(NO3)2溶液中加入少量的稀硫酸,溶液颜色有何变化(请把答案写在横线上)由浅绿色变为黄色,该变化过程的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是CD(设溶液体积不变,不考虑水解因素).
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
(5)在FeSO4的溶液中加入与FeSO4等物质的量的Na2O2固体,恰好使FeSO4转化为Fe(OH)3,写出该反应的离子方程式4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+.
(1)提出假设:(请把下列假设补充完整)
假设1:该固体物质是FeCl2;
假设2:该固体物质是FeCl3;
假设3:该固体物质是FeCl3和FeCl2.
(2)设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如下表:(请在表格的横线处填空)
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
(4)取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是CD(设溶液体积不变,不考虑水解因素).
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
(5)在FeSO4的溶液中加入与FeSO4等物质的量的Na2O2固体,恰好使FeSO4转化为Fe(OH)3,写出该反应的离子方程式4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+.
 ;请写出该反应的一个重要用途:焊接钢轨.
;请写出该反应的一个重要用途:焊接钢轨.
 .
.