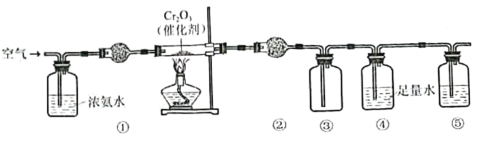
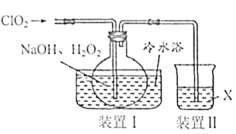
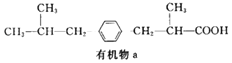
题目内容
【题目】NO氧化反应:![]() 分两步进行,其反应过程能量变化示意图如图,下列说法不正确的是( )
分两步进行,其反应过程能量变化示意图如图,下列说法不正确的是( )
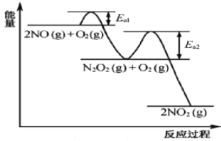
I.![]() H1;II.
H1;II.![]() H2
H2
A.由于![]() ,决定化学反应速率快慢的是反应Ⅱ
,决定化学反应速率快慢的是反应Ⅱ
B.图示过程中,反应物断键吸收能量小于生成物形成所释放的能量
C.升高温度,2NO(g)+O2(g)![]() 2NO2(g)反应速率一定加快
2NO2(g)反应速率一定加快
D.其它条件不变,升高温度,![]() 平衡一定逆向移动
平衡一定逆向移动
【答案】C
【解析】
A.一个化学反应,活化能越大,反应速率越慢,由于![]() ,所以决定化学反应速率快慢的是反应Ⅱ,A正确;
,所以决定化学反应速率快慢的是反应Ⅱ,A正确;
B.图示两个反应都是放热反应,反应物的总能量大于生成物的总能量,所以反应物断键吸收能量小于生成物形成所释放的能量,B正确;
C.升高温度,2NO(g)+O2(g)![]() 2NO2(g)的第一步反应2NO(g)
2NO2(g)的第一步反应2NO(g)![]() N2O2(g)逆向移动,c(N2O2)减小,第二步反应N2O2(g)+O2(g)
N2O2(g)逆向移动,c(N2O2)减小,第二步反应N2O2(g)+O2(g)![]() 2NO2(g)的反应速率可能减小,所以2NO(g)+O2(g)
2NO2(g)的反应速率可能减小,所以2NO(g)+O2(g)![]() 2NO2(g)反应速率不一定加快,C不正确;
2NO2(g)反应速率不一定加快,C不正确;
D.由图中可得,2NO(g)+O2(g)![]() 2NO2(g) H<0,其它条件不变,升高温度,2NO(g)+O2(g)
2NO2(g) H<0,其它条件不变,升高温度,2NO(g)+O2(g)![]() 2NO2(g)平衡一定逆向移动,D正确;
2NO2(g)平衡一定逆向移动,D正确;
故选C。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】化学反应![]() 在四个不同条件下进行。B、D起始为0,反应物A的浓度
在四个不同条件下进行。B、D起始为0,反应物A的浓度![]() 随反应时间
随反应时间![]() 变化情况如下表:
变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ |
| 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 800℃ |
| 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法不正确的是( )
A.实验1,反应在10至![]() 内
内![]()
B.实验2,A的初始浓度![]() ,还隐含的条件是加入了催化剂
,还隐含的条件是加入了催化剂
C.实验3的反应速率v3<实验1的反应速率v1
D.比较实验4和实验1,可推测该反应为吸热反应