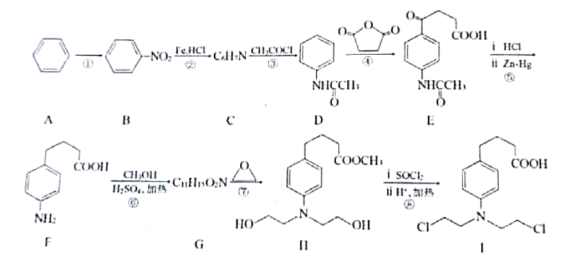
题目内容
【题目】![]() 作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。![]() 溶于
溶于![]() 溶液能发生
溶液能发生![]() 的反应,在低温条件下,可制得
的反应,在低温条件下,可制得![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A.其他条件相同的情况下,![]() 在
在![]() 溶液中的溶解度大于在水中的溶解度
溶液中的溶解度大于在水中的溶解度
B.向![]() 溶液中加入淀粉溶液,溶液变蓝色
溶液中加入淀粉溶液,溶液变蓝色
C.![]() 代替
代替![]() 作为加碘剂,可以减少碘的损失
作为加碘剂,可以减少碘的损失
D.由于还原性![]() ,加入
,加入![]() 可以提高加碘盐(添加
可以提高加碘盐(添加![]() )的稳定性
)的稳定性
【答案】C
【解析】
A.I2溶于KI溶液能发生![]() 的反应,故I2在KI溶液中的溶解度大于在水中的溶解度,A正确;
的反应,故I2在KI溶液中的溶解度大于在水中的溶解度,A正确;
B.反应![]() 为可逆反应,
为可逆反应,![]() 溶液中存在I2,加淀粉溶液变蓝,B正确;
溶液中存在I2,加淀粉溶液变蓝,B正确;
C.![]() 溶于水产生I2,I2有毒,不能代替KI作加碘剂,C错误;
溶于水产生I2,I2有毒,不能代替KI作加碘剂,C错误;
D.还原性![]() ,氧气先氧化
,氧气先氧化![]() ,KI被保护,即加入
,KI被保护,即加入![]() 可以提高加碘盐(添加
可以提高加碘盐(添加![]() )的稳定性,D正确。
)的稳定性,D正确。
答案选C。

 金钥匙试卷系列答案
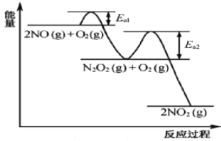
金钥匙试卷系列答案【题目】(1)参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(2)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
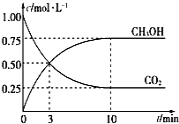
①该反应的平衡常数表达式为K=________;从反应开始到10min,v(H2)=______mol·L-1·min-1;
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母)
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“<”或“=”)0.25mol·L-1。
【题目】乙酰苯胺是用途广泛的化工原料,主要应用于医药、日用化工等诸多领域。某兴趣小组制备流程如下:
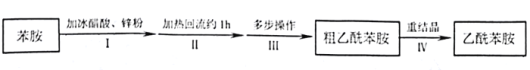
已知:
a.乙酰苯胺在水中的溶解度随温度的升高而增大
b.苯胺在空气中受热易被氧化
c.
名称 | 苯胺 | 醋酸 | 乙酰苯胺 |
沸点 | 184.4 | 117.9 | 304 |
d.反应原理:![]() +CH3COOH
+CH3COOH ![]()
![]() +H2O
+H2O
请回答:
(1)步骤Ⅰ,加入锌粉的目的__________。
(2)步骤Ⅱ实验装置如图(加热装置省略),具体实验过程:装上一刺形分馏柱,插上温度计。用酒精灯加热,使反应溶液在微沸状态下回流,调节加热温度,使柱顶温度105℃左右,反应约![]() 。在反应瓶上装一个刺形分馏柱,其作用是__________。
。在反应瓶上装一个刺形分馏柱,其作用是__________。
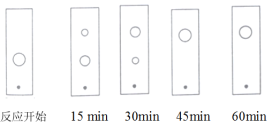
(3)步骤Ⅱ某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流![]() 、
、![]() 、
、![]() 和
和![]() 时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)步骤Ⅳ,关于重结晶的操作,下列说法正确的是________。
A.选蒸馏水作为重结晶提纯乙酰苯胺的溶剂
B.粗制的有机化合物中常常含有有色杂质,可用活性炭进行脱色
C.趁热过滤时,需将菊花形滤纸放入长颈玻璃漏斗,一并放入保温漏斗中
D.趁热过滤也可以用减压过滤代替,提前将布氏漏斗放在沸腾的水浴中加热,防止乙酰苯胺热溶液遇到冷的布氏漏斗而提前析出。
E.冷却结晶时一般是在室温下自然冷却。当溶液降至室温,析出大量乙酰苯胺晶体后,可用冰水进一步冷却,以便晶体析出更加彻底。
(5)物质制备时,通常对纯度有一定要求,从结构与性质角度分析,上述制备过程中“由非氧化还原反应”产生的杂质可能有__________、_________。