题目内容
7.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01mol•L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性.(1)H5IO6是弱电解质(填“强电解质”或“弱电解质”)
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂是H5IO6(填化学式),反应的离子方程式为5H5IO6+2Mn2+=11H++2MnO4-+5IO3-+7H2O.
分析 (1)pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性,可知酸过量;
(2)反应生成高锰酸、碘酸和硫酸,则I元素的化合价降低,Mn元素的化合价升高;弱电解质、水在离子反应中保留化学式.
解答 解:(1)pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性,可知酸过量,则H5IO6为弱电解质,故答案为:弱电解质;
(2)反应生成高锰酸、碘酸和硫酸,则I元素的化合价降低,则氧化剂为H5IO6,该反应的离子反应为5H5IO6+2Mn2+=11H++2MnO4-+5IO3-+7H2O,
故答案为:H5IO6;5H5IO6+2Mn2+=11H++2MnO4-+5IO3-+7H2O.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
2.有A、B、C、D四种短周期元素,其简单离子A+、B2+、C-、D2-的电子层结构相同.则下列比较中正确的是( )
| A. | 原子序数:A>B>C>D | B. | 离子半径:A+>B2+>C->D2- | ||
| C. | 氢化物稳定性:H2D>HC | D. | 金属性:A>B |
19.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O+2AgCl下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | AgCl是还原产物 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | 每生成1molNa2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
14.关于下列化学知识的说法,不正确的是( )
| A. | 可以用淀粉溶液检验加碘盐中是否含碘元素 | |
| B. | 水晶、玛瑙的主要成分是二氧化硅 | |
| C. | “白色污染”是指由不可降解的塑料造成的环境污染 | |
| D. | 硫和氮的氧化物是形成酸雨的主要物质 |
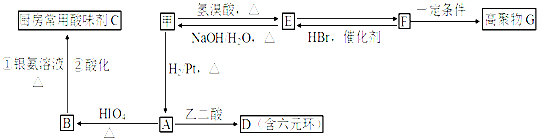
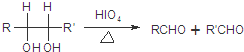
 .
. .
.
 ,PBS的结构简式是
,PBS的结构简式是 .
.

 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子) .
. .
.