题目内容
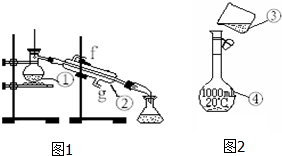
2.某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸进行中和热的测定.Ⅰ.配制0.50mol•L-1NaOH溶液
(1)若实验中约需要240ml0.50mol•L-1NaOH溶液,则应用量筒量取2.5mol•L-1NaOH溶液的体积为50.0mL.
(2)配制0.50mol•L-1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有250mL容量瓶、胶头滴管.
Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生此偏差的原因可能ad(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50mol•L-1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3由大到小的关系为△H3>△H1>△H2.
分析 (1)由于无245mL容量瓶,故应选用250mL容量瓶,根据稀释定律c1V1=c2V2,稀释前后溶质NaOH的物质的量不变,据此计算需要NaOH溶液的体积;
(2)根据配制250mL 0.50mol•L-1NaOH溶液的步骤:计算、量取、稀释、转移、洗涤、振荡、定容、摇匀等操作来选用仪器;
(3)根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(4)a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.硫酸倒入小烧杯时,有少量硫酸溅出,放出的热量基本不变;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;
(5)根据中和热是在稀溶液中强酸与强碱生成1molH2O放出的热量,H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ•mol-1,注意弱电解质的电离吸热,形成沉淀吸热来解答.
解答 解:(1)由于无245mL容量瓶,故应选用250mL容量瓶,根据稀释定律,稀释前后溶质NaOH的物质的量不变,令需要NaOH溶液的体积为V,则:V×2.5mol•L-1=250mL×0.50mol•L-1,解得V=50.0mL,
故答案为:50.0 mL;
(2)配制250mL 0.50mol•L-1NaOH溶液的步骤为:计算、量取、稀释、转移、洗涤、振荡、定容、摇匀等,需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、250mL容量瓶等,其中玻璃仪器为:烧杯、量筒、玻璃棒、250mL容量瓶、胶头滴管.
故答案为:250 mL容量瓶、胶头滴管;
(3)第一次测定温度差为:4.0℃,第二次测定的温度差为:6.1℃,第三次测定的温度差为:3.9℃,第三次测定的温度差为:4.1℃,实验2的误差太大要舍去,三次温度差的平均值为4.0℃,60mLNaOH溶液和40mL硫酸溶液进行中和反应,生成水的物质的量为0.06L×0.50mol•L-1=0.03mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=4.0℃,则生成0.03mol水放出的热量为:Q=m•c•△T=100g×4.18J/(g•℃)×4.0℃=1672J,即1.672KJ,所以实验测得的中和热△H=-$\frac{1.672KJ}{0.03mol}$=-55.7kJ/mol,
故答案为:-55.7kJ/mol;
(4)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.硫酸倒入小烧杯时,有少量硫酸溅出,放出的热量基本不变,中和热的数值不变,故c错误;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:ad;
(5)强酸与强碱的稀溶液发生中和反应热效应表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ•mol-1,现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,因浓硫酸能形成沉淀吸热,氨水电离放热,所以反应热:△H3>△H1>△H2;
故答案为:△H3>△H1>△H2.
点评 本题考查了中和热的计算,大小比较,题目难度中等,注意掌握测定中和热的原理、操作方法.

 期末集结号系列答案
期末集结号系列答案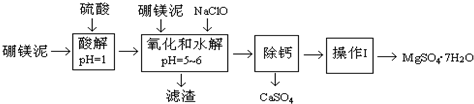
已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸来配制,除量筒、玻璃棒、烧杯、胶头滴管外,还需要的玻璃仪器是烧杯、100mL容量瓶.
(2)滤渣的主要成份有Fe(OH)3、Al(OH)3、MnO2、SiO2
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O═MnO2↓+2H++Cl-.在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O196.8g,则MgSO4•7H2O的产率为70%(相对分子质量:MgSO4•7H2O-246 MgO-40).
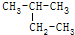 的烃,其正确的命名是( )
的烃,其正确的命名是( )| A. | 1,1-二甲基丙烷 | B. | 2-乙基丙烷 | C. | 3-甲基丁烷 | D. | 2-甲基丁烷 |