题目内容
10.图为两套实验装置.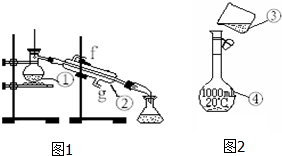
(1)写出下列仪器的名称:
①蒸馏烧瓶;②冷凝管;
(2)仪器①~④中,使用时必须检查是否漏水的有④;(填序号)
(3)若利用装置图1制取蒸馏水,还缺少的仪器是酒精灯,将仪器补充完整后进行的实验操作的名称为:蒸馏,冷却水从g口进;
(4)现需配制1.0mol•L-1的NaOH溶液240mL,其中装置图2是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是未用玻璃棒引流、容量瓶规格选择错误;
(5)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为②①③⑧⑤⑥⑦④;
(6)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为27.4g,该同学应称量10.0g NaOH;

(7)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是④.
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量溶液洒到容量瓶外面 ③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线 ⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线.
分析 (1)依据仪器图象判断仪器名称;
(2)有活塞和玻璃塞的仪器使用时必须检查是否漏水;
(3)依据蒸馏实验加热的条件选择合适的仪器,冷凝水与被冷凝蒸气逆向流动冷浓效果最佳;
(4)配制240ml溶液,应选择250ml容量瓶;移液操作应用玻璃棒引流;
(5)依据配制一定物质的量浓度溶液的一般步骤解答;
(6)根据天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即物品质量=砝码质量+游码质量,如果位置放反,根据左盘的质量=右盘的质量+游码的质量,列等式进行计算;配制240mL溶液,需要选用250mL容量瓶,根据250mL 1mol/L的氢氧化钠溶液中氢氧化钠的物质的量计算出氢氧化钠的质量;
(7)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)图中仪器①是蒸馏烧瓶;②是冷凝管;
故答案为:蒸馏烧瓶;冷凝管;
(2)容量瓶使用时需要上下颠倒,为防止漏水,所以需要检查是否漏水,蒸馏烧瓶、冷凝管、烧杯不需要检查是否漏水;
故答案为:④;
(3)制取蒸馏水的实验名称为蒸馏,必须用酒精灯加热;冷凝管采用逆向通水,即下口是进水口,上口是出水口,
故答案为:酒精灯;蒸馏;g;
(4)配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅;配制多大体积的溶液则选择相应规格的容量瓶,配制240ml溶液,应选择250ml容量瓶;
故答案为:未用玻璃棒引流;容量瓶规格选择错误;
(5)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:②①③⑧⑤⑥⑦④,
故答案为:②①③⑧⑤⑥⑦④;
(6)由左盘的质量=右盘的质量+游码的质量可知:砝码质量=烧杯质量+游码的质量,所以烧杯质量=砝码质量-游码质量,即烧杯质量=20g+10g-2.6g=27.4g;实验室没有240mL容量瓶,实际上配制的是250mL 1mol/L的氢氧化钠溶液,需要氢氧化钠的物质的量为:1mol/L×0.25L=0.25mol,需要氢氧化钠的质量为:40g/mol×0.25mol=10.0g,
故答案为:27.4;10.0g;
(7)①没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液的浓度偏低,故不选;
②转移溶液时不慎有少量溶液洒到容量瓶外面,导致溶质的物质的量偏小,溶液的浓度偏低,故不选;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故不选;
④定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏大,故选;
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线,导致溶液的体积偏大,溶液的浓度偏小,故不选;
故选:④
点评 本题考查了蒸馏、一定物质的量浓度溶液的配制,熟悉实验原理和仪器的使用方法是解题关键,题目难度不大.

| A. | 通过蒸发结晶稀硫酸的方式可以除去混合物NaCl(Na2CO3)中的Na2CO3,可提纯得到NaCl | |
| B. | 通过点燃O2的方式可以除去混合物CO2(CO)中的CO,可提纯得到CO2 | |
| C. | 通过过滤稀盐酸的方式可以除去混合物Zn(Ag)中的Ag,可提纯得到Zn | |
| D. | 通过蒸馏的方式可以除去混合物自来水(Cl-)中的Cl-,从而提纯得到自来水 |
| A. | 铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| B. | 硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 小苏打投入过量的澄清石灰水中 HCO3-+Ca2++OH-=CaCO3↓+H2O |
| A. | pH=1的溶液中:Fe2+、NO3-、Na+、SO42- | |
| B. | 水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- |
| A. | 能导电的物质就是电解质 | |
| B. | 离子反应一定使溶液中所有离子的浓度都发生变化 | |
| C. | 复分解型离子反应必须具备有沉淀、气体、难电离的物质中之一的条件才能发生 | |
| D. | 酸碱中和反应都能用离子方程式:H++OH-=H2O表示 |
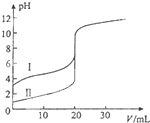
| A. | Ⅱ表示的是滴定醋酸的曲线 | |
| B. | V(NaOH)=20ml时,${C_{(C{l^-})}}$=${C_{(C{H_3}CO{O^-})}}$ | |
| C. | PH=7时,滴定醋酸消耗V(NaOH)小于20ml | |
| D. | V(NaOH)=10ml时,醋酸溶液中:${C_{(N{a^+})}}$>${C_{(C{H_3}CO{O^-})}}$>${C_{({H^+})}}$>${C_{(O{H^-})}}$ |
| 选项 | 实验目的 | 实验方案 |
| A | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| B | 证明与苯环相连的甲基易被氧化 | 向2mL甲苯中加入3滴酸性KMnO4溶液,振荡;向2mL苯中加入3滴酸性KMnO4溶液,振荡,观察现象 |
| C | 比较HB和HA的酸性强弱 | 取等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体,观察收集到的气体哪个多 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)若实验中约需要240ml0.50mol•L-1NaOH溶液,则应用量筒量取2.5mol•L-1NaOH溶液的体积为50.0mL.
(2)配制0.50mol•L-1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有250mL容量瓶、胶头滴管.
Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生此偏差的原因可能ad(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50mol•L-1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3由大到小的关系为△H3>△H1>△H2.
