题目内容
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是_____(填字母序号)
A.Fe B.FeO C.Fe3O4 D.Fe2O3
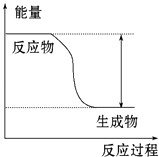
(2)现代利用铁的氧化物循环分解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。

①已知:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g) ΔH1=+19.3kJ·mol-1
3FeO(s)+CO2(g) ΔH1=+19.3kJ·mol-1
3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) ΔH2=-57.2kJ·mol-1
Fe3O4(s)+H2(g) ΔH2=-57.2kJ·mol-1
C(s)+CO2(g)![]() 2CO(g) ΔH3=+172.4kJ·mol-1
2CO(g) ΔH3=+172.4kJ·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________________。
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度(T)的变化关系。
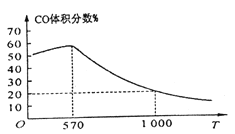
i. 当温度低于570℃时,对于反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g) ,温度降低,CO的转化率_____ (填“增大”、“减小”或“不变”)。
3Fe(s)+4CO2(g) ,温度降低,CO的转化率_____ (填“增大”、“减小”或“不变”)。
ii. 当温度高于570℃时,随温度升高,反应Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g)平衡常数的变化趋势是______(填“增大”、“减小”或“不变”);1000℃时,该反应的化学平衡常数的数值是__________。
3FeO(s)+CO2(g)平衡常数的变化趋势是______(填“增大”、“减小”或“不变”);1000℃时,该反应的化学平衡常数的数值是__________。
(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是_____________。
②基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
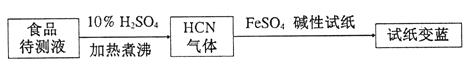
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用____________。
【答案】 C C(s)+H2O(g)=H2(g)十CO(g) ΔH=+134.5kJ/mo1 增大 增大 4 3[Fe(CN)6]4-+ 4Fe3+= Fe4[Fe (CN)6]3↓ 碱性条件下,Fe2+与CN-结合生成[Fe (CN)6]4-,Fe2+被空气中O2氧化生成Fe3+,Fe3+与[Fe(CN)6]4-反应生成普鲁士蓝使试纸显蓝色
【解析】(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,答案选C;(2)①Ⅰ.Fe3O4(s)+CO(g)3FeO(s)+CO2(g)△H1═+19.3kJmol-1
Ⅱ.3FeO(s)+H2O(g)Fe3O4(s)+H2(g)△H2═-57.2kJmol-1
Ⅲ.C(s)+CO2(g)2CO(g)△H3═+172.4kJmol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJmol-1;②i. 根据图中信息可知,当温度低于570℃时,对于反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),温度降低,CO的体积分数降低,平衡正向移动,CO的转化率增大;ii.当温度高于570°C,随温度升高,反应Fe3O4(s)+CO(g)3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,1000℃时CO体积分数为20%,结合三行计算列式计算得到平衡浓度,设起始浓度CO为1mol/L,消耗CO浓度为x
3Fe(s)+4CO2(g),温度降低,CO的体积分数降低,平衡正向移动,CO的转化率增大;ii.当温度高于570°C,随温度升高,反应Fe3O4(s)+CO(g)3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,1000℃时CO体积分数为20%,结合三行计算列式计算得到平衡浓度,设起始浓度CO为1mol/L,消耗CO浓度为x
Fe3O4(s)+CO(g)3FeO(s)+CO2(g)
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
![]() =20%,解得:x=0.8mol/L,K=
=20%,解得:x=0.8mol/L,K=![]() =4;(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe (CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+ 4Fe3+= Fe4[Fe (CN)6]3↓;②基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-与Fe3+反应生成普鲁士蓝使试纸显蓝色。
=4;(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe (CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+ 4Fe3+= Fe4[Fe (CN)6]3↓;②基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-与Fe3+反应生成普鲁士蓝使试纸显蓝色。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案